



سلام سلاااام🤩
بچه ها تو این تاپیک میخوایم دانشجوها هم مثل کنکوریا ساعت مطالعه شون رو اعلام کنن ✌
هم انگیزه بشه برای فارغ التحصیلای آلاء تا تو محیط دانشگاه هم دست از تلاشِ آلائی برندارن 💪و هم اینکه کنکوریای با درسایی که دانشجوها میخونن یکم آشنا میشن🤗
پس از امشب استارت این تاپیک رو میزنیم و هرشب میایم و میگیم در طول روز چ درسایی رو خوندیم ،چند ساعت و چیکارا کردیم😁
دعوت میکنم از @فارغ-التحصیلان-آلاء که باهامون همراه بشن🤝
خیلی ممنون از z Gheibi و M.ba78 بابت پیشنهاد و همراهیشون❤
راستی از romisa جانم هم دعوت میکنم بهمون سر بزنه و همراهیمون کنه😍
سلام به بچه های عزیز آلا🌻
خب دوستان تو این تاپیک قراره که تجربه هامون رو از دانشجویی بگیم
نحوه درس خوندن، نحوه ارتباطات،خوابگاه و... هر صحبتی که تو ذهن تون هست
که ورودی های امسال مون بتونن استفاده کنن😊
ممکنه حتی یه سری نکات و صحبت ها بگیم که خودمون هم ندونیم و بهمون کمک بشه😅
و اینکه بچه های جدید حتما سوالات شون رو بپرسن
@فارغ-التحصیلان-آلاء @رتبه-های-انجمن-آلاء
@تجربیا @ریاضیا @انسانیا
@بچه-های-تجربی-کنکور-1402
@بچه-های-ریاضی-کنکور-1402
@همیار
سلام.
تا حالا فک کردین به یه سیستم عامل دیگه مهاجرت کنین؟ گاهی اوقات حس نکردین از ویندوز خسته شدین؟
خب من درمانش رو دارم بیاین لینوکس بریزیم، همه!
اصلا لینوکس چیه؟
خب اینه: "لینوکس (Linux) یک سیستم عامل رایگان و متن باز است که بر پایه هسته Linux (کرنل) توسعه داده شده است. هسته لینوکس مسئولیت مدیریت منابع سختافزاری و ارتباط بین نرمافزار و سختافزار در سیستم را بر عهده دارد."
متن بازی (open source ) یعنی چی؟ یعنی کد هاش برای همه آزاد و همه می تونن بیاین لینوکس رو تغییر بدن، (گویی انگولش کنن) اما ویندوز این شکل نیست کدهای توسعه ویندوز، رو فقط خود مایکروسافت داره. (واسه همین ویندوز گرونه 199 دلار ویندوز 11 پرو 😲 )
خلاصه اش اقا اینکه لینوکس یه هسته ی اصلی داره حالا می رسیم به توزیع های لینوکس.
اینم تاریخچه ش :در سال 1991 فردی با نام لینوس توروالدز (Linus Torvalds)، دانشجوی رشته علوم کامپیوتر در دانشگاه هلسینکی فنلاند، تصمیم گرفت یک سیستم عامل جدید بر اساس یونیکس (Unix) طراحی کند. او نیازمند یک سیستم عامل برای استفاده شخصی و توسعه برنامههای خود بود. لینوس کد منبع سیستم عامل خود را در اینترنت منتشر کرد و خواستار کمک و بازخورد از جامعه برنامهنویسی شد. این کد با عنوان “هسته لینوکس” شناخته میشد.
گروهی از برنامهنویسان از سراسر جهان به لینوس پیوستند و شروع به توسعه و بهبود هسته لینوکس کردند. این جامعه برنامهنویسی فعال با همکاری بینالمللی سایر برنامه نویسان باعث شد هسته لینوکس به سرعت رشد کند. در سال 1994، نسخه اولیه رسمی Linux با ورژن 1.0 منتشر شد. این نسخه اولیه شامل امکانات اساسی سیستم عامل شبیه به یونیکس بود و از آن پس، توسعه و بهبودهای بیشتری در هسته لینوکس صورت گرفت.
(اینجاش مهمه)
با گذر زمان، جامعه برنامهنویسی Linux رشد کرد و شرکتها و سازمانها نیز به توسعه و پیشرفت لینوکس کمک کردند. این شرکتها شامل ردهت (RedHat)، اینتل (Intel)، آیبیام (IBM) و بسیاری دیگر بودند. به مرور و با گذشت زمان، Linux به عنوان یک سیستم عامل پرکاربرد، به ویژه در سرورها و دستگاههای همراه، شناخته شد. همچنین، توزیعهای لینوکس محبوبی مانند اوبونتو (Ubuntu)، فدورا (Fedora) و دبیان (Debian) با امکانات و رابط کاربری متنوعی ارائه شدند.
از آن زمان تا به امروز، Linux به یکی از قدرتمندترین و پرطرفدارترین سیستم عاملها تبدیل شده است و در بسیاری از زمینهها از توزیع های مختلف Linux استفاده میشود، از جمله سرورها، دستگاههای هوشمند و رایانههای شخصی.
اگه به میخواین در آینده مهندسی نرم افزار، کامپیوتر، ای تی، شبکه و هزاران چیز دیگه مربوط به علوم کامپیوتر و کامپیوتر بخونین پیشنهاد می کنم همین الان لینوکس رو نصب کنید.
حالا چه توزیعی بریزیم؟
من نزدیک 1.5 ساله از ویندوز مهاجرت کردم به لینوکس و تاحالا سه تا توزیع مختلف روی ماشین مجازی ریختم و تست کردم. عملا انچنان تفاوت خاصی با هم ندارند ولی
برای شروع پیشنهاد می کنم (یعنی خیلی نوبی) : اوبونتو (ubuntu) یا linux mint یا manjaro ، این توزیع های خوبن
من در حال حاضر از manjaro استفاده می کنم که واقعا توزیع مناسبیه، ولی اگه اصلا لینوکس کار نکردین ubuntu یا linux mint بریزین.
حالا چجوری لینوکس بریزیم؟
مثلا برای نصب ubuntu میرم تو گل سرچ می کنیم download ubuntu و وبسایت رسمی ubuntu نسخه اخرین نسخه LTS اوبنتو رو بریزین ( در حال حاضر اخرین نسخه Ubuntu 24.04.1 LTS) هستش
[LTS یعنی چه مخفف long-term support یعنی ما معنی پنج سال به روز رسانی رایگان امنیتی میدیم که یعنی توزیع پایدار و با ثباتی واسه همین برای تازه کارا مناسبه]
یه فایلی به پسوند iso. دانلود میشه.
با نرم افزار refus این فایل رو روی یه فلش یا سی دی بوت می کنیم ( آموزش هاش داخل آقای گوگل هست و می تونین سی دی اوبونتو رو بخرید که بوت شده)
فلش رو وصل می کنیم، سیستم یه ریستارت می زنیم بعد قبل اینکه سیستم بالا بیاد یکی از دکه های f12 یا f10 یا del یا ... ( با توجه به نوع مادربرد، لپتاپ و ... احتمال 99 درصد f12 هستش) از منو بوت فلش رو انتخاب می کنیم و تامام وارد پنجره نصب اوبونتو میشیم که به شدت ساده هستش، داخل اینترنت میلیون ها آموزش نصب اوبنتو و بقیه توزیع ها هستش)
▶️| #معرفی_رشته
بریم برای یه معرفی رشته ی جداب
#مهندسی_پزشکی
☁️رشته ی مهندسی پزشکی چیه؟
ساخت تجهیزات پزشکی یکی از کارهایی هست که بچه های این رشته انجام میدن
این علم تلاش می کنه تا مهندسین پزشکی بتونن از ایده های پزشکی استفاده کنن
🌥کسی که این رشته رو خونده باید چه ویژگی هایی داشته باشه؟
خلاقیت و نو اوری داشته باشه
مسلط به زبان انگلیسی باشه
نرم افزار های تخصصی طراحی رو بلد باشه
قادر به تحلیل نیاز های مشتریان و بیماران باشه
ریاضی، فیزیک، زیست و شیمی اش قوی باشه
⛅️ تهش چی میشه؟
کار در شرکت های تخصصی تجهیزات پزشکی
کار در شرکت های دانش بنیان در حوزه ی مهندسی پزشکی
نمایندگی فروش و خدمات پس از فروش تجهیزات پزشکی وارداتی
طراحی و ساخت دستگاه های تشخیص مشکلات پزشکی و بیماری ها
کار و تحقیق در جنبه های فنی و مهندسی مربوط به سیستم های بیولوژیکی انسان ها و حیوانات
نصب، تنظیم و نگهداری، تعمیر یا پشتیبانی فنی تجهیزات پزشکی با عنوان متخصص تجهیزات پزشکی بیمارستانی
🌤 مسیر تحصیلی اش چیه؟
کارشناسی: مهندسی پزشکی
کارشناسی ارشد: بیوالکتریک، بیومکانیک، بیومتریال
دکتری: مهندسی بافت، رباتیک پزشکی، پردازش سیگنال ها با تصاویر پزشکی، ابزار دقیق پزشکی، مهندسی ورزش، بیوالکتریک، بیومکانیک، بیومتریال
منبع یک کاناله امیدوارم اطلاعات درست باشند. باز هم خودتون بررسی کنید
@ida-shateri
@بچه-های-کنکور-ریاضی-1400
@ریاضیا
سلام
امیدوارم حالتون خوب باشه
یلدای گذشته مبارکتون 🙂❄️🌸
یه سوال داشتم از دانشجو های آلایی
روش خاصی برای جزوه نویسی دارین ؟
اون دسته دروسی که علاوه بر فایل ، صحبتای استاد هم مهمن رو چیکار میکنین ؟
من خودم نکات اضافه ی گفته شده سر کلاس و فایل خود استاد ( در صورتی که استاد فایلشو بده 🙄 ) رو با هم تو جزوه پاک نویس میکنم ولی خب آخر ترم با حجم بالای نکات چرکنویس و فایلای نوشته نشده روبرو میشم😐💔
و از طرفی خوندن و تسلط روی مطالب نسبت به جزوه نویسی مهم تره ، مخصوصا الان که نزدیک به امتحانات ترم هستیم
ممنون میشم تجربیاتتون در این زمینه رو به اشتراک بذارین 🙏🌸
سلول های بنیادی راهی به آینده
-
سلولهایی که مانند آب، انعطافپذیرند و مملو از قابلیتهای ناشناخته و اسرارآمیز؛ این توانایی را دارند که به هر سلولی تمایز بیابند و کارایی خاصی پیدا کنند. از این رو است که با پیشرفت دانش و فناوری، قدر و اهمیت این سلولها در درمان بیماریهای ناشناخته و لاعلاج، بسیار پررنگ شده است.
نقش اثربخش سلولهای بنیادی در درمان
این فناوری به مدد پژوهشهای کاربردی و مرز دانش بسیاری توسعه یافته و امیدها را دست یافتن به دستاوردهایی که تا پیش از این تحقیقشان ناممکن به نظر میرسید قوت داده است. به طور مثال نگاه پژوهشگران و متخصصان به این کاربرد حوزه از درمان، احیای سلولها و کارهای آزمایشگاهی، فراتر رفته و ساخت اندامهای حیاتی بدن به کمک سلولهای بنیادی بیش از گذشته به واقعیت نزدیک شده است.
بیماریهای مختلف، ممکن است به بافتها و اندامهای بدن آسیبهای جبرانناپذیری برسانند که ادامه حیات بیمار را تنها با جایگزین کردن اندام حیاتی از کار افتاده با نوع سالم آن ممکن کند. با توجه به رشد فزاینده جمعیت و ابتلا به بیماریهای اینچنینی، نیاز به پیوند اعضا به طور فزایندهای افزایش یافته است، اما اندام موجود برای پیوند در حال حاضر بسیار کمتر از تقاضا است و این امکان وجود دارد که تقاضا در آیندهای نزدیک نیز افزایش یابد.
به همین دلیل، یکی از دغدغههای مهم در حوزه سلامت امکان ساخت اعضای بدن یا بررسی امکان این موضوع است که چگونه ممکن است عملکرد اعضای بدن در آینده با یک اندام یا روش دیگر جایگزین شود.
فناوریها و روشهای نوآورانه بسیاری وجود دارد که به طور بالقوه ممکن است به یافتن جایگزینی برای عملکرد اعضای بدن کارآمد باشند. با توسعه پژوهشها و افزایش استفاده از فناوری های جدید، اکنون میشود به یک راه و روش تازه برای کمک به بیماران، جدیتر فکر کرد.
نیاز فزاینده به اعضای جایگزین؛
آینده جایگزینی اعضای بدن توسط سه متغیر تعیین خواهد شد. اولین متغیر «نیاز» است ، به ویژه اینکه تعداد ساخت اندامهای جایگزین شده با گذشت زمان تغییر می کند، متغیر دوم راهبردها و فناوریهای جدیدی است که برای جایگزینی آن اندامها در دسترس خواهد بود. متغیر سوم مجموعه ای از موانع زیست شناختی و اجتماعی است که ممکن است مانع جایگزینی عملکرد اندام شود.
نیاز به جایگزینی اعضا ممکن است در سالهای پیش رو به شدت تغییر کند. درمانهای جدید برای بیماری ها، تغذیه بهتر و رویکردهای نوآورانه و فناورانه برای توسعه و رونق بهداشت عمومی از شیوع برخی از بیماریها که باعث نارسایی عضو میشوند جلوگیری کرده و بنابراین نیاز به پیوند را کاهش میدهد.
در هر حال، افزایش طول عمر ناشی از ارتقای فناوریها و روشهای نوآورانه مراقبتهای پزشکی، تغذیه و بهداشت عمومی ، بخش عمده ای از مردم را از بیماریها مانند دیابت و نارسایی قلب یا کلیه مصون خواهد داشت.
توسعه فناوریها و امید به تولید اندامها بافتهای جایگزین
پیشرفت در زیستفناوری، سلولهای بنیادی و پژوهشها در حوزه مولکولی، پروتئومیکس و سایر زمینه ها ممکن است تشخیص بیماری های کشنده را مدتها پیش از ظهور علائم بالینی امکان پذیر کند. یک نمونه خون ممکن است وجود سرطان در کلیه یا ریه را قبل از بروز ضایعه نشان دهد. این تحول پزشک و بیمار را هدایت می کند تا اندامهایی که بالقوه محل بروز سرطان هستند با اندامهای سالم جایگزین و از مرگ بیمار جلوگیری کند.
توسعه دانش و فناوری پیوند پیشگیرانه میتواند تقاضا را برای اعضای جایگزین، به طرز چشمگیری گسترش دهد و همانطور که مفهوم جایگزینی مناسب را تغییر می دهد به طور چشمگیری تغییر می کند.نیاز فزاینده به پیوند این پرسش را ایجاد می کند که کدام فناوری های جدید می توانند برای رفع این نیاز کارآمدتر و جذاب تر باشند. پیوند از افراد زنده در حال حاضر پاسخگوی تقاضای جایگزینی قلب، ریهها، کلیهها و کبد نیست. شاید بتوان با افزایش پیوند اعضا از اجساد، در دسترس بودن به برخی از اندام ها را بهبود بخشید. اما با این وجود پیوند به روش مرسوم باز هم نمیتواند نیاز فزاینده به پیوند اعضا را پاسخ دهد. بر همین اساس فناوریهای نوظهور مانند کاشت دستگاهها و تجهیزات جایگزین، سلولهای بنیادی، مهندسی بافت، ارگانوژنز و پیوند بیگانه مورد توجه قرار گرفته است.
دستگاههایی که به طور کامل قابل کاشت هستند، چند سالی است که به عنوان جایگزینی برای جبران عملکرد برخی از اعضای بدن مورد استفاده قرار میگیرند و حتی به صورت آزمایشی برای جایگزینی عملکرد قلب در دسترس قرار گرفتهاند. دستگاه ها فقط در شرایط حاد استفاده می شوند و استفاده از آنها عوارض و آسیبهای قابل توجهی ایجاد میکند.
با این حال، فناوری این حوزه از ظرفیت توسعه برخوردار است و میتوان تصور کرد که ممکن است روزی به عنوان دستگاههای جایگزین عملکرد قلب مورد استفاده قرار بگیرد. البته در دیگر حوزهها نمیتوان چنین امیدواری داشت، اگرچه تجهیزات و روشهای تهاجمی مانند دیالیز میتوانند عملکرد ریهها و کلیه ها را جایگزین کنند، اما استفاده مستمر از این دستگاهها و روشها، عوارضی جدی مانند عفونت و زخم را به دنبال دارد.توانمندی سلولها در جایگزینی بافتها و اندامها
از آنجاکه سلولهای بنیادی توانایی تکثیر و تمایز به سلولهای نسبتاً بالغ از انواع مختلف را دارند، میتوانند به عنوان روشی کارآمد و اثربخش برای توسعه بافتها و اندامهای جایگزین، مورد توجه قرار بگیرند.
سلول های بنیادی جنینی می توانند به هر عضوی در بدن تبدیل شوند و وقتی در بلاستوسیست قرار می گیرند این کار را میکنند. این دسته از سلولهای بنیادی میتوانند برای جایگزینی هر عضوی در بدن استفاده شوند. با این حال ، حداقل دو عامل این احتمال را محدود می کند. نخست اینکه سلولهای بنیادی جنینی یک فرد، از نظر ژنتیکی به طور اجتناب ناپذیری با فرد تحت درمان متفاوت است و استفاده از بافت ها یا اندام های حاصل از این سلولها ممکن است به سرکوب سیستم ایمنی نیاز داشته باشد.
محدودیت در استفاده از سلولهای بنیادی جنینی یا سلولهای بنیادی تولید شده توسط شبیهسازی هستهای این است که در حالی که می توان آن سلول ها را به سلول ها و بافت های متمایز تبدیل کرد، اما مشخص نیست که به وسیله چه سلول هایی میتوان اعضا را خارج از جنین و به چه شکلی تولید کرد. اما این روش فناورانه، به کمک سلولهای بنیادی امیدها را برای ساخت و توسعه بافت و اندامهای جایگزین تفویت میکند.
فناوری دیگری که بعضاً برای جایگزینی اعضای بدن پیشنهاد می شود، ارگانوژنز است. ارگانوژنز به رشد اندامهای دست نخورده یا بافتهای شبیه اندام از سلولهای بنیادی اشاره دارد. همانطور که ارگانوژنز به طور طبیعی در جنین اتفاق می افتد، همچنین میتواند زمانی رخ دهد که بافت ها یا سلول های عضوی از جنین اولیه در بافت میزبان قرار گرفته یا در حیوانات زنده کاشته شوند.
به عنوان مثال، بافتهای کلیوی رشدیافته در جنین می توانند در شرایط آزمایشگاهی گلومرول بالغ و اندام هایی در پستانداران بالغ تولید کنند.
از بافت ها و سلول های جنین می توان برای تولید بافتهای مهندسی شده نیز استفاده کرد. استفاده از ارگانوژنز توسط منبع و ایمنی زایی بافتهای جنین محدود می شود. بافت جنین انسان برای این منظور مناسب نیست. برخی پیشنهاد کرده اند که به جای آن از بافتهای جنینی حیوانات استفاده شود. با این حال ، این روش نیز به عنوان راهکاری برای توسعه فناوری بافت و اندامهای جایگزین در دست مطالعه و توسعه است.
در صورت بررسی دقیق و تجزیه روشها و فناوریهای گوناگون، به طوری که از مزایای هر فناوری بهره برده شود، می توان موانع جایگزینی اندام را برطرف کرد.
با استفاده از هریک از این فناوریهای از تولید سلولهای بنیادی و استفاده از سلولهای بنیادی بدست آمده در یک مکان مناسب در یک جنین زنوژن دستاوردهای خوبی حاصل شده است.
به طور مثال، مطالعههای اخیر سلولهای بنیادی انسانی وارد شده به خوک جنین می توانند به روش های طبیعی و هیستوتیپی در مکان های مناسب در جنین خوک بالغ شوند. بافت هایی که در این سیستم ژنوژنیک شروع به بلوغ می کنند ممکن است برداشت شوند و سلولهای متمایزشده به فرد منتقل می شوند تا بلوغ و تمایز کامل رخ دهد.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
دانشمندان یک ماده بیولوژیکی جدید ایجاد کرده اند که رگ های خونی و استخوان را دوباره رشد می دهد و یک روش تک مرحله ای هنگام ترمیم نقص در استخوان های بلند را ارائه می دهد.
این مطالعه توسط محققان RCSI و مرکز SFI AMBER انجام شده و در ژورنال Controlled Release چاپ شده است.
تحقیقات قبلی محققان RCSI نشان داده بود که فعال سازی ژن حساس به مکانیسم، به نام فاکتور رشد جفت (PGF) ، در دوزهای مختلف باعث بازسازی استخوان و رشد رگ های خونی جدید می شود. با استفاده از این دانش، محققان یک ماده زیستی تولید کردند که PGF را در غلظت های مختلف ارائه می دهد.
با الهام از روش طبیعی بازسازی نقص استخوان ، ماده اولیه ابتدا دوز بالایی از PGF آزاد می کند و رشد رگهای خونی را تقویت می کند و به دنبال آن با دوز پایدار پایین تری از آن باعث بازسازی استخوان می شود. هنگامی که این ماده در یک مدل پیش بالینی آزمایش شد، ماده بیولوژیکی با موفقیت نقایص استخوان بلند را ترمیم کرده و در عین حال عروق خونی را رشد داد.
مواد زیستی موجود که هم رگ های خونی و هم رشد استخوان را تقویت می کنند، معمولاً به استفاده از بیش از یک داروی درمانی نیاز دارند. علاوه بر این، داروهایی که برای استفاده در کلینیک تأیید شده اند با عوارض جانبی خطرناکی همراه بوده و نیاز به استراتژی های جدید را برجسته می کنند.
پروفسور فرگال اوبراین، محقق اصلی تحقیق و مدیر تحقیق و توسعه ی RCSI گفت: "قبل از شروع آزمایشات بالینی، آزمایشات بیشتری لازم است و در صورت موفقیت، این ماده بیولوژیکی می تواند هنگام ترمیم نقایص استخوانی برای بیماران بسیار مفید باشد."
https://medicalxpress.com/news/2021-04-biomaterial-regrows-blood-vessels-bone.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
زیست شناسان از سلول های بنیادی پرتوان انسان برای رشد مدل های قلب کوچک، به نام "کاردیوئید" استفاده کرده اند که خود به خود و بدون نیاز به داربست، به صورت یک محفظه ی توخالی سازماندهی می شوند. این دستاورد، امکان ایجاد واقعی ترین ارگانوئیدهای قلب تا به امروز را فراهم کرده است.
پیش از این، دانشمندان از طریق مهندسی بافت، ارگانوئیدهای قلبی سه بعدی با رویکردی که شامل مونتاژ سلول ها و داربست هاست را ساخته اند. اما این ارگانوئیدهای مهندسی شده پاسخ فیزیولوژیکی مشابه به قلب انسان نسبت به آسیبها نداشته اند و بنابراین اغلب نمی توانند به عنوان مدل خوبی برای بیماری ها عمل کنند.
این تیم تحقیقاتی می خواستند تکوین قلب به صورت خود- سازماندهی شده را در ظرف کشت تقلید کنند. آنها با فعال کردن هر شش مسیر سیگنالینگ شناخته شده در رشد قلب جنینی باعث خود-سازماندهی سلولهای بنیادی شدند. با تمایز سلول ها، شروع به تشکیل لایه های جداگانه، شبیه به ساختار دیواره قلب کردند. بعد از یک هفته، این ارگانوئیدها به صورت خود به خودی به یک ساختار سه بعدی که دارای حفره ای محصور است (یعنی یک مسیر رشد خود به خودی مانند قلب انسان) سازمان داده شدند. علاوه بر این، این تیم متوجه شد که بافت دیواره مانند کاردیوئید به طور ریتمیک منقبض می شود تا مایع اطراف حفره را فشار دهد.
همچنین این تیم نحوه ی واکنش کاردیوئیدها به آسیب های بافتی را نیز آزمایش کردند. آنها از یک میله فولاد سرد برای یخ زدن بخشهایی از این قلب کوچک استفاده کرده و سلولهای زیادی را در محل از بین بردند. محققان مشاهده کردند که مشابه آنچه معمولا پس از آسیب هایی مانند حمله قلبی مشاهده می شود، مرگ سلولی اتفاق افتاد و بلافاصله پس از آسیب، فیبروبلاست های قلبی - نوعی سلول مسئول ترمیم زخم - شروع به مهاجرت به سمت نقاط آسیب دیده و تولید پروتئین برای ترمیم آسیب کردند.
این تیم قصد دارد ارگانوئیدهای قلبی با چندین محفظه مانند آنچه در قلب واقعی انسان دیده می شود را ایجاد کند. بسیاری از بیماری های مادرزادی قلب هنگامی اتفاق می افتند که سایر محفظه ها شروع به تشکیل می شوند، بنابراین مدل چند محفظه ای به پزشکان کمک می کند تا درک بهتری از شکل گیری نقص در جنین داشته باشند.
https://www.sciencedaily.com/releases/2021/05/210520133927.htm
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
یک مطالعه تحقیقاتی در Ludwig Cancer Research کشف کرده است که چگونه می توان یک زیر مجموعه قدرتمند اما بی عملکرد سلولهای ایمنی ضد سرطان که اغلب در تومورها یافت می شود را برای درمان سرطان احیا کرد.
این تحقیق با هدایت پینگ چیه هو و لی تانگ از Ludwig Lausanne از École Polytechnique Fédérale de Lozan انجام شده است. این مطالعه توصیف می کند که چگونه یک فاکتور ایمنی معروف به اینترلوکین -10 عملکرد لنفوسیت های T نفوذپذیر تومور "خسته" (TILs) را که تا کنون ثابت شده است در برابر تحریکات ایمنی درمانی غیرقابل نفوذ است را احیا می کند. همچنین نشان می دهد هنگامی که این فاکتور همراه با روشهای درمانی سلول استفاده شود، می تواند تومورهای ملانوم و سرطان روده بزرگ را در مدلهای موش از بین ببرد. یافته های این مطالعه در شماره ی فعلی Nature Immunology گزارش شده است.
https://medicalxpress.com/news/2021-05-revive-potent-immune-cells-cancer.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
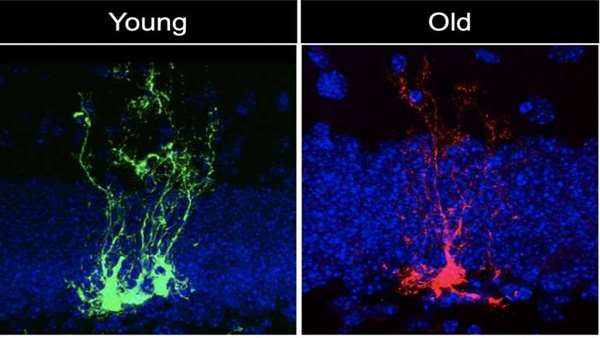
در مطالعه جدید منتشر شده درCell Stem Cell، تیمی به سرپرستی دانشمند سلولهای بنیادی USC، مایکل بوناگوئیدی، نشان داد که سلولهای بنیادی عصبی - سلولهای بنیادی سیستم عصبی - به سرعت پیر می شوند.
بوناگوئیدی، استادیار زیست شناسی سلول های بنیادی و پزشکی بازساختی و مهندسی پزشکی در دانشکده پزشکی Keck از USC گفت: "دو نوع پیری زمانی و پیری بیولوژیکی وجود دارد که این دو مثل هم نیستند." "ما در مورد پیری بیولوژیکی سلولهای بنیادی عصبی که به ویژه در معرض آسیب های زمانی نیز هستند، تحقیق می کنیم. بیشتر ما با پیرتر شدن و همچنین زوال عقل، بیماری آلزایمر، صرع و آسیب مغزی را تجربه می کنیم. "
در این مطالعه، اولین نویسنده آلبینا ابرایوا که برای بررسی مغز موش های جوان، میانسال و پیر به همکاران خود پیوست. آنها با ردیابی سلولهای بنیادی عصبی یا NSC ، طی چند ماه ، "NSC کوتاه مدت" را شناسایی کردند که به سرعت به سلولهای عصبی تمایز می یابد و همچنین "NSC طولانی مدت" شناسایی شد که به طور مداوم تقسیم و تکثیر می یابد تا یک جریان مداوم جهت ذخیره سلولهای بنیادی با توانایی تولید انواع مختلف سلول در مغز را حفظ کند. این جمعیت کلیدی" NSC های طولانی مدت " کمتر تقسیم می شوند و با پیر شدن موش ها قادر به حفظ تعداد خود نیستند.
در ادامه، دانشمندان هزاران ژن در" NSC طولانی مدت" را بررسی کردند که کمتر تقسیم می شوند و به حالت سکون فرو می روند. فعالیت ژنی NSC های ساکن در حیوانات جوان و میانسال بسیار متفاوت است. همانطور که انتظار می رفت، تغییراتی در ژن هایی ایجاد شد که نحوه تقسیم" NSC طولانی مدت" را کنترل کرده و همچنین سلول های عصبی جدید و سلول های دیگر مغز را تولید می کنند. نکته قابل توجه اینست که تغییرات مهمی در فعالیت ژن مربوط به پیری بیولوژیکی در سنین پایین نسبت به آنچه پیش بینی شده بود، وجود داشت. این ژن های پیشبرنده ی پیری، کار سلول ها را در ترمیم آسیب DNA، تنظیم فعالیت ژنتیکی، کنترل التهاب و کنترل سایر استرس ها دشوارتر می کند.
دانشمندان در میان ژن های پیشبرنده ی پیری، بیشتر شیفته ی ژن Abl1 شدند که مرکز شبکه ای از ژن های بهم پیوسته را تشکیل می دهد.
ابرایوا گفت: "ما به ژن Abl1 علاقه مند بودیم، زیرا هیچ کس تا به حال نقش آن را در زیست شناسی سلول های بنیادی عصبی - چه در حال رشد و چه در پیری مطالعه نکرده است. "
دانشمندان می توانند با استفاده از داروی شیمی درمانی مورد تأیید FDA به نام Imatinib، به راحتی فعالیت ژن Abl1 را مهار کنند. دانشمندان به مدت شش روز به موش های مسن تر دوز Imatinib دادند. پس از آنکه دارو فعالیت ژن Abl1 را مسدود کرد، NSC ها در هیپوکامپ که بخشی از مغز که مسئول یادگیری و حافظه است، شروع به تقسیم بیشتر و تکثیر کردند.
بوناگوئیدی گفت: "ما موفق شده ایم که باعث تقسیم بیشتر سلول های بنیادی عصبی بدون تخلیه شدن شویم و این مرحله اول است." "مرحله دوم القا این سلولهای بنیادی برای ساختن سلولهای عصبی بیشتر خواهد بود. در مرحله سوم نشان می دهیم که این سلولهای عصبی اضافی در واقع یادگیری و حافظه را بهبود می بخشد. کارهای زیادی باقی مانده است که باید انجام شود، اما این مطالعه پیشرفت هیجان انگیزی را در جهت هدف ما از شناسایی داروهایی که می توانند با افزایش سن، مغز ما را جوان کنند، نشان می دهد. "
https://medicalxpress.com/news/2021-04-reveals-neural-stem-cells-age.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

سنگاپور به اولین کشور در جهان تبدیل شد که فروش گوشت کشت شده در آزمایشگاه را تصویب میکند. آژانس دولتی غذای سنگاپور به شرکتی موسوم به "Eat Just" که یک استارتاپ آمریکایی است که بیشتر به دلیل تخم مرغهای گیاهی خود شهرت دارد، اجازه فروش گوشت مرغ کشت شده در آزمایشگاه خود را صادر کرد. این شرکت اعلام کرد که عرضه این گوشت محدود خواهد بود و فعلا تنها یک رستوران این ناگتها را میفروشد. با این حال، این شرکت قصد دارد با افزایش ظرفیت تولید خود، در نهایت گوشت آزمایشگاهی خود را به طور مستقیم به مصرفکنندگان بفروشد. این گوشت آزمایشگاهی با جایگزینهای گیاهی که از شرکتهایی مانند "Impossible Foods" و "Beyond Meat" دیدهایم، متفاوت است. در این مورد، گوشت آزمایشگاهی واقعی است، چرا که با برداشتن سلولهای بنیادی از ماهیچه یا بافت چربی یک حیوان و قرار دادن آن در محیط آزمایشگاهی که از رشد آنها پشتیبانی میکند، ایجاد میشود.
مدیرعامل این شرکت، این فرآیند را با عمل آوردن ماءالشعیر مقایسه میکند و میگوید که خوردن مرغ حاصل از این فرآیند، هم بیخطر است و هم شامل مقدار زیادی پروتئین و یک ترکیب متنوع اسید آمینه است. علاوه بر این، یک مزیت عمده در فرآیند تولید "Eat Just" این است که هیچ آنتی بیوتیکی ندارد. وقتی صحبت از سلامتی انسان میشود، درمییابیم که استفاده بیش از حد از آنتی بیوتیکها در صنایع دام و طیور در حال تبدیل شدن به نوعی بمب ساعتی برای بشر است. این استارتاپ آمریکایی تقریباً دو سال برای دریافت این مجوز تلاش کرده است. این شرکت به عنوان بخشی از فرآیند صدور مجوز باید نشان میداد که میتواند مرغ کشت شده در آزمایشگاه را به طور مداوم تولید کند. اقدام سنگاپور برای مجوز دادن به این شرکت میتواند سایر کشورها را به پیروی از این امر ترغیب کند، اما تصویب قانونی این کار در ایالات متحده و سایر کشورها احتمالاً سالها طول بکشد، چرا که به ویژه در ایالات متحده، گروههای لابی قدرتمندی وجود دارد که از منافع دامداریها و مزارع پرورش طیور پشتیبانی میکنند و با گوشت آزمایشگاهی مخالف خواهند بود.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
محققان و پزشکان در کالج دانشگاه لندن (UCL) و بیمارستان اورموند با مطالعه اثربخشی درمان های CAR-T در کودکان مبتلا به سرطان خون ، زیرمجموعه ای از سلول های T را کشف کرده اند که احتمالاً در موفقیت این روش درمانی موثر است. نتایج درمان این مطالعه در Nature Cancer به چاپ رسیده است.
پژوهشگران این مطالعه اذعان داشتند که " در طول آزمایشات بالینی ، نتایج بسیار دلگرم کننده ای را در بیماران مبتلا به سرطان خون مشاهده کرده ایم ، اما هنوز مشخص نیست که چرا سلول هایT در طولانی مدت برای برخی از بیماران وجود دارند و از بازگشت سرطان جلوگیری می کنند ، در حالی که دیگران همچنان در خطر بالای عود مجدد قرار دارند. لذا برای اطمینان از اینکه یک روش درمانی سرطان خون موثر است ، می بایست تأثیر طولانی مدتی بر روی بدن داشته باشد و سلولهای سرطانی را از بین ببرد. در این مطالعه سعی کردیم منشا و ماهیت سلول های T را کنترل کنیم تا مسیرهای پاسخ طولانی مدت را کنترل کنیم.
در درمان مبتنی بر CAR-T ، گیرنده های آنتی ژن کایمریک (CAR) در سطح سلول های T می توانند سلول های سرطانی را به طور خاص تشخیص دهند. برای بررسی عوامل زمینه ساز واریانس موفقیت CAR-T درمانی در سرطان خون ، محققان سلولهای CAR-T بیماران درگیر در مطالعه PARPALL فاز I را ارزیابی کردند ، که از یک مولکول جدید CAR با نام CAT-19 استفاده شده توسط مرکز تحقیقات سرطان UCL استفاده شده است.
با استفاده از روشی به نام "بارگذاری کدگذاری محل" ، تیم سرنوشت سلولهای CAR-T را پس از درمان بین بیماران با سلولهای CAR-T قابل تشخیص در خون آنها بیش از 2 سال پس از درمان و کسانی که سلولهای CAR-T خود را از دست داده بودند تا 2 ماه پس از درمان مقایسه کردند.
در ادامه این پژوهشگران اظهار داشتند که با استفاده از این روش شناسایی و لیبل کردن، توانستیم ببینیم که "سلول های T حافظه سلول های بنیادی" نقش اصلی را در هنگام پاسخ اولیه ضد لوسمی و همچنین در نظارت ایمنی بعدی(جایی که بدن سلول های سرطانی را تشخیص می دهد و از بین می برد) بازی می کنند و این نشان می دهد که این زیر گروه کوچک سلول T برای موفقیت طولانی مدت در درمان بسیار مهم است.
این مطالعه همچنین نشان می دهد که پزشکان می توانند انواع سلولهای CAR-T موجود پس از درمان سرطان خون را اندازه گیری کنند تا احتمال حفظ سلولهای CAR-T و جلوگیری از عود بیماری را تشخیص دهند.
بیاسکو از محققین اصلی این مطالعه افزود: "بسیار جالب توجه بود که ببینیم چگونه استفاده از فناوری جدید بارکد برای مطالعه سلولهای T CAR از چنین اطلاعات مهمی در مورد آنچه این سلولها بعد از تزریق به بیماران اتفاق می افتد رونمایی می کند. ما در حال حاضر قصد داریم فناوری را که در موسسه UCL ایجاد کردیم گسترش دهیم و این یافته ها را در گروه های بزرگتر از بیماران معتبر ارزیابی کنیم. "
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
محققان در مطالعه ای جدید نشان داده اند که وزیکول های خارج سلولی(EVs) مشتق از فیبروبلاست ها موجب فعال شدن فیبروبلاست ها، مهاجرت سلول های اندوتلیالی و تشکیل آزمایشگاهی ساختارهای لوله ای شکل و در نهایت بهبود درون تنی زخم ها از طریق افزایش تشکیل و بلوغ کلاژن می شوند.
هم چنین به نظر می رسد که این وزیکول های خارج سلولی بیان VEGF، تشکیل عروق خونی و القای زوائد پوستی را نیز افزایش می دهند. به عقیده محققین این وزیکول های خارج سلولی مشتق از فیبروبلاست ها ممکن است کاندیدا و محصول سلولی مناسبی برای درمان زخم ها باشند، بدون آن که مشکلات مربوط به استفاده از خود سلول ها را به همراه داشته باشند.
https://stemcellsjournals.onlinelibrary.wiley.com/doi/abs/10.1002/stem.3310
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

محققان دانشگاه توکیو متروپولیتن (ژاپن) ناهمگنی در پاسخگویی سلولهای بنیادی مزانشیمی (MSC) به مدول الاستیک بسترهای کشت را به صورت کمی توصیف کرده اند. پویایی قرارگیری پروتئین های YAP و RUNX2 در هسته سلول و چگونگی تغییر آن با تغییر میزان سختی محیط کشت، مبنایی را برای طراحی بستر مدول الاستیک جهت کنترل وضعیت سلول های بنیادی فراهم می کند.
می توان تمایز سلول های بنیادی مزانشیمی را با قرار دادن آنها روی سطوحی با سختی مکانیکی یا مدول الاستیک متفاوت، کنترل کرد. سلولهای بنیادی مزانشیمی نسبت به محیط دقیق قرارگیری خود بسیار حساس هستند. کنترل مطمئن بر سلول های بنیادی مزانشیمی برای تحقیقات و کاربردهای بالقوه زیست پزشکی بسیار ارزشمند خواهد بود.
هیرومی میوشی (دانشیار دانشگاه متروپولیتن توکیو) و تیم آنها پویایی وابسته به مدول الاستیک یک انتقال دهنده مکانیکی، YAP و یک عامل تمایز استخوانی (RUNX2) را در سه گروه مختلف MSC مورد تجزیه و تحلیل قرار دادند.
این تیم از یک ژل ژلاتین استایرن شده با مدول الاستیک قابل کنترل استفاده کردند که قابلیت تولید مجدد به مراتب بهتر از دیگر گزینه های محبوبتر کلاژن بود.
درصد سلولهای با YAP موضعی در هسته با افزایش مدول الاستیک به طور خطی افزایش یافته و در 10 کیلو پاسکال برای همه دسته های تجزیه و تحلیل شده به صورت ثابت می شود. افزایش درصد با مدول الاستیک بستر با همان عملکرد خطی توصیف شد.
به طور مشابه، درصد سلول های با محلی سازی هسته ای RUNX2 نیز با مدول الاستیک بستر به صورت خطی افزایش یافته و در 5 کیلو پاسکال به صورت ثابت در می آید.
با استفاده از این نوع اطلاعات، هر کسی می تواند یک ژل با سختی خاص ایجاد کرده و به طور فعال سطح YAP / RUNX2 را در هسته سلولهای بنیادی مزانشیمی کنترل کند. با این کار می توان زمان و چگونگی تمایز سلول ها را تنظیم کرد.
تیم تحقیقاتی امیدوارند که این سطح جدید کنترل بر سرنوشت سلول به تسریع تحقیقات در مورد سلولهای بنیادی مزانشیمی کمک کرده و منجر به کاربردهای درمانی هیجان انگیزی شود.
https://www.regmednet.com/mesenchymal-stem-cell-fate-controlled-by-varying-culture-stiffness/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

متخصصان علوم پزشکی در آمریکا اعلام کردند که توانستهاند با استفاده از ویروس ایدز در قالب یک پروژه ژندرمانی، بیماری کشنده «کودک حبابی» را درمان کنند. بیماری کودک حبابی یک بیماری نادر مادرزادی است که در آن نوزادان بدون داشتن سیستم ایمنی طبیعی به دنیا میآیند .نداشتن سیستم ایمنی باعث میشود حتی یک بیماری سرماخوردگی ساده نیز بتواند این کودکان را به کام مرگ بکشد و به همین دلیل این افراد از بدو تولد درون یک محفظه ایزوله قرار میگیرند. ریشه نام بیماری «کودک حبابی» به موردی از آن در دهه ۷۰ میلادی بازمیگردد. در آن زمان پسری از تگزاس آمریکا که مبتلا به این نقص متولد شده بود برای ۱۲ سال در محیطی ایزوله و داخل یک حباب پلاستیکی محافظ زندگی کرد تا میکروبها نتوانند با وی تماس داشته باشند.
پژوهشگران با پیشرفت پزشکی دریافتند که این بیماری میتواند از بروز نقص در ۲۰ ژن ناشی شود و دختران را نیز همچون پسران تحت تاثیر قرار دهد. از این رو نام بیماری که در ابتدا به «پسر حبابی» مشهور شده بود به «کودک حبابی» تغییر پیدا کرد. برآورد میشود از هر ۲۰۰ هزار مورد تولد، یک نوزاد مبتلا به بیماری کودک حبابی باشد. محققان علوم پزشکی در روش تازه موفق شدهاند در نوزادان و کودکانی که با این بیماری متولد شدهاند سیستم ایمنی طبیعی خلق کنند.
برای این منظور آنان ابتدا ژنهای لازم برای اصلاح دیانای کودکان را در آزمایشگاه ساختند. سپس این ژنهای سالم را درون ویروسهای غیرفعال ایدز جاسازی کردند و آن را به درون بدن بیمار تزریق کردند. از آنجا که ویروس ایدز حتی در حال غیرفعال نیز توانایی در اختیار گرفتن دیانای فرد و گسترش آن در سراسر بدن را دارد، ژن سالم به این روش تکثیر و در نهایت سیستم ایمنی بدن بیمار فعال شده است. نتایج آزمایش تجربی نشان میدهد که بدن ۴۸ نفر از ۵۰ نفری که تحت درمان قرار گرفتهاند اکنون توانایی مبارزه با میکروبها را دارا است. دو کودکی که در این آزمایش نتوانستهاند بر اثر ژندرمانی بهبود یابند با پیوند مغز استخوان مورد درمان قرار گرفتهاند. پزشکان میگویند هنوز برای اینکه بتوان گفت این کودکان به طور کامل خوب شدهاند زود است اما تاکنون به نظر میرسد آنها مشکلی ندارند.
پیوند مغز استخوان از خواهر یا برادر همسان ژنتیکی میتواند این اختلال را درمان کند، اما اکثر کودکان فاقد اهدا کننده مناسب هستند و درمان با مغز استخوان نیز روشی خطرناک به حساب میآید. پسر تگزاسی در پروسه همین درمان جان خود را از دست داد. دکتر دونالد کوهن از بیمارستان یوسیالای لسآنجلس گفت: ما در حال درمان یک بیماری هستیم که در حالت عادی قدرت کامل کشندگی دارد. وی درباره کودکان درمان شده افزود: آنها اساسا آزاد هستند، به مدرسه میروند و کارهای معمولیشان را انجام میدهند، بدون نگرانی از اینکه عفونت زندگیشان را تهدید کند.
https://www.statnews.com/2021/05/11/aids-virus-used-in-gene-therapy-to-fix-bubble-baby-disease/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
میکروارگانیسم ها مانند باکتری ها و بیوپلیمرهای مشتق شده از آنها می توانند در مواد زیستی و بازسازی بافت استفاده شوند. روش های مختلفی برای بازسازی بافت های آسیب دیده به کار رفته است، اما استفاده از پروبیوتیک ها و مواد بیولوژیکی حاصل از باکتری ها با بهره وری اقتصادی و تولید با بهبود و ویژگی های بسیار کاربردی می تواند راه حل جدیدی در بازسازی بافت باشد. باکتری ها می توانند انواع زیادی از بیوپلیمرها را سنتز کنند. این بیوپلیمرها دارای بسیاری از خواص مطلوب مانند سازگاری زیستی و تجزیه بیولوژیکی هستند که آنها را کاندیداهای خوبی برای بازسازی بافت می کند.
https://www.futuremedicine.com/doi/10.2217/rme-2020-0116
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
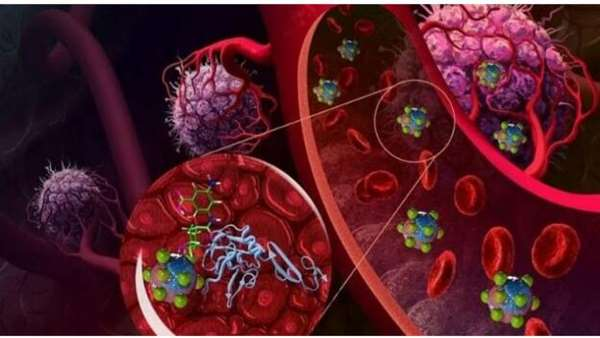
یک مطالعه مبتنی بر مواد بیولوژیکی توسط محققان دانشگاه تورنتو با همکاری Ripple Therapeutics Inc روشی را ایجاد کرده است که کنترل بهتری بر پروفایل ترشح مواد دارویی در ایمپلنت ها دارد و می تواند بازار داروهای کلاسیک را مختل کند.
به طور معمول ، مولکول های دارویی در داخل پوسته های پلیمری قابل تجزیه یا تجزیه نشده قرار می گیرند و به آرامی داروهای درمانی را آزاد می کنند که اغلب با کنترل پروفایل های انتشار مشکل هستند. در این مطالعه ، محققان توانستند به طور مستقیم از مولکول های دارو به عنوان خود وسیله حمل و نقل استفاده کنند و روند ساخت و آماده سازی روند درمانی را برای کلینیک بسیار بهبود بخشند.
پروفسور Paul Santerre (دندانپزشک ، BME) ، نویسنده ی مسئول این مطالعه در این تحقیق می گوید: "هدف از تحقیق و کاربردهای اثبات شده آن ، ساختن یک سیستم قوی است که بتواند در تحویل کلاسهای مختلف مولکول های دارویی مورد استفاده قرار گیرد." "در این مطالعه ، ما از کورتیکواستروئیدها برای تولید ساختارهایی استفاده کردیم که خود به خود جمع می شوند و الیاف ، میله ها ، نانوذرات و اشکال دیگر را تشکیل می دهند. این فرم های قوی فرسایش سطحی را به روشی کنترل شده انجام داده و به این ترتیب دارو را برای بیش از هفته ها تا ماهها بدون کمک ماتریس ثانویه تحویل می دهند. "
کورتیکواستروئیدها اغلب به صورت بالینی برای رفع التهاب استفاده می شوند. به عنوان مثال ، آنها در محصولات تجاری رایج مانند استنشاق کننده های آسم یافت می شوند. این مولکول ها همچنین می توانند از طریق کاشت یا مهندسی بافت به مناطقی در بدن انسان منتقل شوند - جایی که یک ماده زیست تخریب پذیر به طور سنتی مولکول ها را کپسوله می کند و با گذشت زمان به آرامی آزاد می کند.
از نظر تئوری این ایده عالی است ، اما ترجمه بالینی با چالش هایی روبرو است.
https://news.engineering.utoronto.ca/new-method-can-improve-drug-delivery-in-implants/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
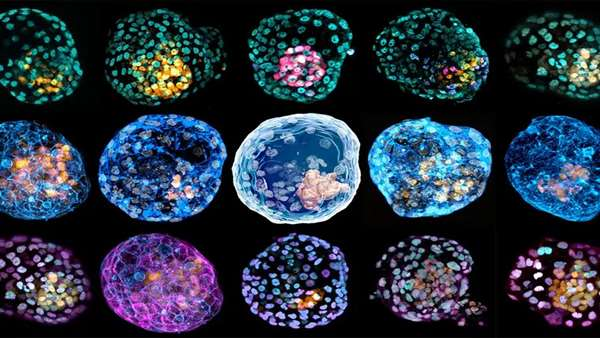
بخش عمدهای از سقطهای جنینی در دو هفته اول پس از بارداری و زمانی اتفاق می افتند که زنان از بارداری خود اطلاع ندارند. این نوع سقط با عنوان سقط خاموش شناخته میشود و علل عمده آن، عدم کاشت جنین در مراحل اولیه و یا عدم رشد آن پس از کاشت داخل رحمی است. یک تیم تحقیقاتی ، مدلی از جنین انسان با استفاده از سلولهای پوستی تولید کرده است که امکان مطالعه مراحل اولیه رشد جنین انسان، علل ناباروری، بیماریهای مادرزادی و تأثیر سموم و ویروسها روی جنینهای اولیه را برای دانشمندان فراهم میکند.
این تیم از طریق باز برنامهریزی سلولهای فیبروبلاست پوستی با استفاده از تکنیک باز برنامهریزی هستهای"Nuclear Reprogramming"موفق به ایجاد یک ساختار سلولی سه بعدی به نام iBlastoids در یک داربست ژلهای سه بعدی شده اند. این ساختار از لحاظ ظاهر و نشانگرهای مولکولی کاملا شبیه به بلاستوسیستهای انسانی بوده و ساختارهایی شبیه به توده سلولی داخلی، سلولهای اپی بلاست و اندودرم اولیه، حفره بلاستوسل و یک لایه بیرونی سلول شبیه به تروفکتودرم در آن وجود دارد. همچنین، iBlastoids میتواند باعث ایجاد سلولهای بنیادی پرتوان و تروفوبلاست شود و مدل سازی آزمایشگاهی مراحل اولیه کاشت جنین را امکان پذیر کند.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
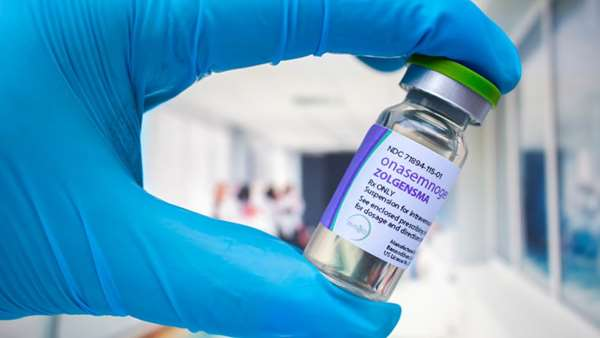
آتروفی عضلانی نخاعی یک وضعیت بسیار جدی ، ناتوان کننده و ناراحت کننده است که تأثیرات بسزایی در همه جنبه های زندگی مبتلایان به آتروفی عضلانی نخاعی و خانواده و مراقبان آنها دارد. دارویی که در حال حاضر توسط NICE برای درمان آتروفی عضلانی نخاعی نوع 1 ، 2 و 3 قبل از علائم توصیه می شود ، داروی ضد حساسیت الیگونوکلئوتید nusinersen است که باید به طور منظم مصرف شود. زولگنسما(Zolgensma) به صورت یک تزریق داخل وریدی تجویز می شود و برای استفاده در نوزادان تا 12 ماهگی با نوع 1 آتروفی عضلانی نخاعی تأیید شده است. در پیش نویس راهنمای NICE همچنین استفاده از زولگنسما در نوزادان دارای آتروفی عضلانی نخاعی پیش از علامت توصیه می شود. برای کودکان 7 تا 12 ماهه ، به دلیل محدود بودن اطلاعات بالینی موجود برای این گروه سنی ، لازم است که یک تیم بالینی چند در مورد نوع درمان آن پژوهش و بررسی کنند.
زولگنسما نشان دهنده یک پیشرفت مهم در درمان آتروفی عضلانی نخاعی است که نه تنها می تواند به کودکان اجازه دهد نقاط عطف مهم مانند نشستن و راه رفتن مستقل را بدست آورند ، بلکه برای برخی از نوزادان که قبل از علائم آنها تشخیص داده می شود ، ممکن است به عنوان یک درمان باشد. هزینه ژن درمانی برای هر دوز 1.79 میلیون پوند است. بویزن ادامه داد: همانطور که در بسیاری از روشهای درمانی جدید برای بیماریهای بسیار نادر وجود دارد ، شواهد محدود نشان می دهد که عدم اطمینان در مورد مزایای طولانی مدت زولگنسما وجود دارد. انتظار می رود که صنعت داروسازی در جهت بهبود کارایی خود برای ارائه چنین نوآوری های پرهزینه با حداقل هزینه ممکن که برای پایداری سیستم های مراقبت بهداشتی در سراسر جهان ضروری است ، کار کند.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
محققان در انستیتوی کارولینسکا استفاده از ونتوکلاکس با دوز کم را که یک داروی آزمایشی است ، برای درمان بیماری سرطان ناهمگن مولتیپل میلوما در بیماران مبتلا به عود درمان های استاندارد بررسی کرده اند. این یافته ها در مجله American Journal of Hematology منتشر شده و امید جدیدی برای درمان مولتیپل میلوما فراهم می کند.
مولتیپل میلوما (MM) یک بیماری سرطانی است که از زیرگروههای متمایزی تشکیل شده است و تقریباً 20 درصد مرگ ناشی از تمام بیماریهای مرتبط با خون را تشکیل می دهد. درمان این بیماری در دهه های گذشته ارتقا یافته است، با این حال برخی از بیماران همچنان دچار عودهای متعدد می شوند که منجر به مرگ می شود.
محققان در Karolinska Institutet، این مطالعه را بر روی 25 بیمار، دوز 400 میلی گرم در روز Venetoclax (دارویی که در حال حاضر برای درمان انواع مختلف سرطان خون استفاده می شود) را در درمان بیماران MM و AL-amyloidosis که از قبل تحت درمان قرار گرفته اند، را تجویز نمودند. این مطالعه نشان می دهد که انتخاب Venetoclax با دوز پایین برای کاهش عوارض جانبی این دارو، از نظر میزان پاسخ و زنده ماندن بسیار مهم بود.
این مطالعه در مجموع شامل 25 بیمار (17 بیمار MM و 8 AL-آمیلوئیدوز) بود که با گذشت زمان نسبت به درمان استاندارد مقاوم شده و منجر به بیماری تهاجمی تر شدند. بیماران مبتلا به ناهنجاری کروموزومی به نام t (11؛ 14) سپس با دوز کم ونتوکلاکس تحت درمان قرار گرفتند. این مطالعه نشان می دهد که درمان Venetoclax در 44 درصد از کل بیماران ، 71 درصد در AL-آمیلوئیدوز و 33 درصد در زیر گروه های MM موثر بود. در حالی که 20 بیمار (80 درصد) برخی از عوارض جانبی را مشاهده کردند ، این موارد در همه موارد قابل کنترل بود و هیچ گونه مرگ و میر ناشی از درمان Venetoclax مشاهده نشد. عارضه جانبی غالب حالت تهوع بود که در 32 درصد بیماران مشاهده شد.
نویسنده مسئول مقاله اذعان داشت: همچنین یک روش ساده را برای پیش بینی پاسخ ونتوکلاکس تا سطح 91 درصد از ویژگی های خاص ایجاد کردند. این روش درمانی می تواند برای پزشکی فرد محور مورد استفاده قرار گیرد و پیاده سازی آن در بخش پاتولوژی در بیمارستان دانشگاه کارولینسکا آسان است.
Refrence:https://medicalxpress.com/news/2021-05-treatment-multiple-myeloma.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
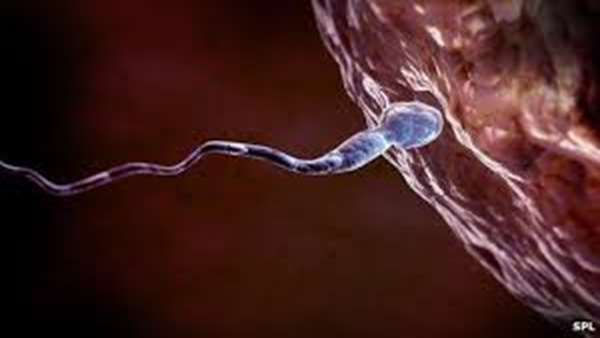
شانس بازیابی باروری از طریق پیوند سلول های بنیادی اسپرم به اندازه پرتاب سکه تصادفی است. اما تیمی از دانشمندان استراتژی جدیدی را ابداع کردند که به عنوان "سکه ای وزن دار" عمل می کند و می تواند برای دستیابی به نتایجی که در آن باروری با موفقیت بازیابی می شود، شانس بیشتری ایجاد کند.
توانایی سلول های بنیادی در رفع عملکردهای ضعیف بافت های میزبان پس از پیوند، یک موفقیت نجات دهنده در درمان شرایط غیرقابل درمان قبلی بوده است. سرنوشت سلول های بنیادی پیوندی تقریباً مانند پرتاب سکه غیرقابل پیش بینی است. پس از پیوند، ممکن است آنها تکثیر شده، به یک نوع بافت دیگر تبدیل شوند یا از بین بروند.
سلولهای بنیادی اسپرماتوگونیال نیز از همان سرنوشت تصادفی پیش بینی نشده در نتایج پیروی می کنند. اما گروهی از دانشمندان باروری به سرپرستی یوشیاکی ناکامورا از دانشگاه هیروشیما روش جدیدی را کشف کردند که به خوبی ناباروری موش های نر را درمان میکند - این نوید خوبی برای برنامه های آینده در بازسازی اسپرم انسان پس از درمان سرطان و جمعیت دوباره گونه های تهدید شده و در معرض خطر است. نتایج مطالعه آنها در مجله Cell Stem Cell منتشر شده است.
تیم بین المللی دانشمندان ژاپنی و انگلیسی با نگاهی به وضوح و از نزدیک به تک سلولی ها، سرنوشت سلولهای بنیادی اسپرماتوگونیال پیوند یافته در موش ها را پیگیری کردند. آنها سلولهای بنیادی اسپرم موش را در موش های نابارور کاشتند و دریافتند که در دراز مدت فقط یک بخش کوچک از آنها به عنوان اسپرماتوگونی کار می کند و بقیه به انواع دیگری از سلول ها تغییر می کنند، یا عملکردشان متوقف شده و مرگ سلولی رخ می دهد.
آنها با استفاده از این دیدگاه ها، روش جدیدی را ایجاد کردند که می تواند به طور مصنوعی سرنوشت سلول های بنیادی اسپرم را تنظیم کند تا احتمال افزایش مجدد جمعیت را به حدی برساند که مجددا باروری برقرار شود. به طور خلاصه، آنها پس از پیوند، از یک بازدارنده سنتز اسید رتینوئیک استفاده می کنند که به طور موقت از تمایز سلول های بنیادی اسپرم جلوگیری می کند. بازدارنده های شیمیایی در جایی که سلول های بنیادی سرنوشت تجدید حیات خود را انتخاب می کنند، به ایجاد نتیجه کمک می کند.
https://www.sciencedaily.com/releases/2021/06/210607161035.htm
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
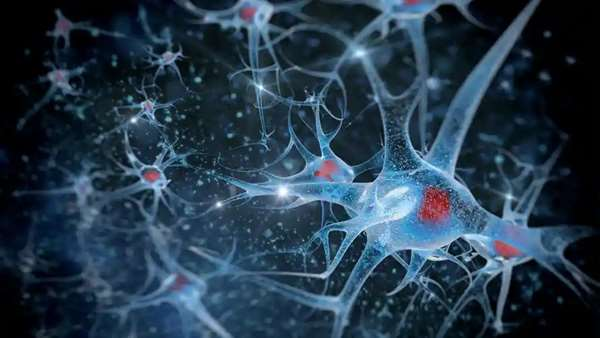
بنا به اظهار محققان، سلول های بنیادی، سلول های مغزی جدیدی تولید می کنند که برای یادگیری و حافظه در طول زندگی فرد بالغ ضروری هستند. اگر این سلول های بنیادی بدون کنترل تقسیم شوند، ذخایر آن ها تمام می شود. به نظر می رسد ژن FOXO3 با جلوگیری از تقسیم سلول های بنیادی تا زمانی که استرس وجود دارد، نقش خود را ایفا می کند.
از جمله عواملی که باعث استرس بافت مغز می شود می توان به التهاب، تشعشعات و یا فقدان مواد غذایی کافی اشاره کرد. در این پژوهش به طور اختصاصی به بررسی اثر مواجهه سلول های بنیادی مغز با استرس اکسیداتیو (که ناشی از تولید گونه های مضر اکسیژن در بدن می باشد) پرداخته شده است. نتایج نشان می دهد که پروتئین FOXO3 مستقیما تحت تاثیر استرس اکسیداتیو قرار می گیرد، به طوریکه FOXO3 به هسته سلول های بنیادی منتقل می شود و در آنجا ژن های پاسخ به استرس را فعال می کند. این پاسخ، منجر به تخلیه یک ماده مغذی به نام S-آدنوزیل متیونین (SAM) می شود که برای همکاری با پروتئین لامین در تشکیل یک پوشش در اطراف DNA در هسته سلول های بنیادی ضروری است. در فقدان SAM، لامین نمی تواند این مانع قوی را تشکیل دهد و سلول این DNA بدون پوشش را با یک عفونت ویروسی اشتباه گرفته و منجر به نوعی پاسخ ایمنی به نام پاسخ اینترفرون نوع یک می شود. این امر باعث می شود سلول بنیادی خاموش شده و تولید سلول های عصبی جدید متوقف شود.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
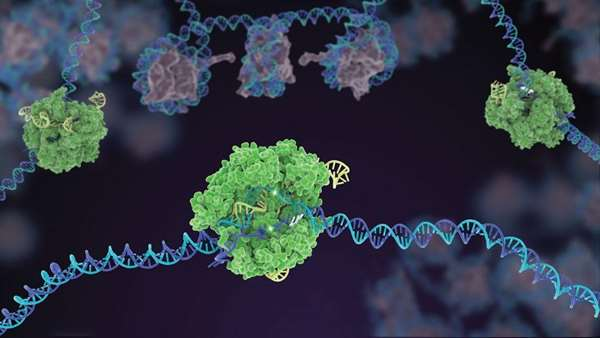
پژوهشگران چینی در آکادمی علوم پکن یک غربالگری مبتنی بر CRISPR/Cas9 گسترده را با استفاده از دو نوع سلول پیش ساز مزانشیمی انسانی که پیری تسریع شده را نشان می دهند، انجام دادند. این سلول های پیش ساز مزانشیمی از سلول های بنیادی جنینی انسانی مشتق شدند که حامل جهش های بیماری زایی بودند که منجر به بیماری پیری تسریع شده سندرم ورنر و سندرک پروجریای هاچینسون-گلیفورد می شوند.
با استفاده از این مدل ها، محققین ژن هایی را شناسایی کردند که نقصان آن ها منجر به پیری سلولی می شود و در هر دو مدل پیری سلولی ذکر شده وجود داشتند که از جمله آن ها می توان به KAT7 اشاره کرد که یک هیستون استیل ترانسفراز است. غیر فعال سازی KAT7 موجب کاهش استیلاسیون هیستون H3 شد و این امر نیز موجب سرکوب رونویسی شد و پیری سلول های پیش ساز مزانشیمی را کاهش داد. به عقیده محققین استفاده از غربالگری ژنتیکی مبتنی بر CRISPR/Cas9، یک روش قوی برای کشف ژن های دخیل در پیری مانند KAT7 است و می توان آن ها را هدف درمانی مناسبی برای ایجاد مداخلات درمانی برای پیری دانست.
https://stm.sciencemag.org/content/13/575/eabd2655
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

سرفصل ها
روز نخست
معرفی سلول درمانی و ژن درمانی (چیستی و ماهیت، تفاوت ها)
چرا سلول درمانی؟ چرا ژن درمانی؟ (ضرورت انجام سلول درمانی و ژن درمانی)
روشهای انجام سلول درمانی و ژن درمانی (معرفی روش ها و ابزارهای مورد نیاز در سلول درمانی)
کارگاه آموزشی کشت و نگهداری سلول های بنیادی جنینی
روز دومباید ها و نبایدهای سلولدرمانی و ژن درمانی (بیان محدودیت ها و چالش های سلول درمانی)
معرفی بازار و ظرفیت های تجاری
کارگاه آموزشی نحوه کشت و نگهداری سلول های بنیادی مزانشیمی مغز استخوان
روز سوممهندسی بافت (ساخت اندام های بدن در آزمایشگاه)
کارگاه آموزشی روش های انتقال ژن
برگزاری آزمونhttps://www.royan-edu.ir/product/2th-royan-summer-school/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

https://www.royan-edu.ir/product/هفدهمین-کنگره-بین-المللی-سلولهای-بنیا/
https://www.royan-edu.ir/product/بیست-و-دومین-کنگره-بین-المللی-بیولوژی-ت/
z Gheibi
romisa
@فارغ-التحصیلان-آلاء
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470




