شیمی طوری



-
 عوامل موثر بر آنتالپی پیوند
عوامل موثر بر آنتالپی پیوند
1️⃣شعاع اتمهای درگیر در پیوند
هر چه شعاع اتمها بیشتر باشد، طول پیوند بلندتر و شکستن آن راحتتر و در نتیجه آنتالپی پیوند کمتر است. آنتالپی پیوند با شعاع رابطه عکس دارد. مقایسه شعاع در هالوژنها: I2 > Br2 > Cl2
مقایسه شعاع در هالوژنها: I2 > Br2 > Cl2
 مقایسه آنتالپی پیوند: Cl2 > Br2 > I2
مقایسه آنتالپی پیوند: Cl2 > Br2 > I2 مقایسه شعاع: HI > HBr > HCl
مقایسه شعاع: HI > HBr > HCl
 مقایسه آنتالپی پیوند: HCl > HBr > HI
مقایسه آنتالپی پیوند: HCl > HBr > HI2️⃣تعداد پیوند بین دو اتم
هر چه تعداد پیوند بین دو اتم بیشتر باشد شکستن آن پیوند سختتر و آنتالپی آن بیشتر خواهد بود. آنتالپی پیوند کربن-کربن سه گانه (آلکین) بیشتر از کربن-کربن دوگانه (آلکن) و آنهم بیشتر از کربن-کربن یگانه است.
آنتالپی پیوند کربن-کربن سه گانه (آلکین) بیشتر از کربن-کربن دوگانه (آلکن) و آنهم بیشتر از کربن-کربن یگانه است. -
Fa Fa در شیمی طوری



 گفته است:
گفته است:@kosar-mottaghi اینا مهمن ؟ من دهمم معلممون یه کوله بار واکنش داده گفته حفظ کنین همشم انگلیسی درهم برهم...اصلنم ازش تو امتحان نمیاره با اینکه امتحاناش تستیه

 بخونمشون؟ آخه خیلی سخته
بخونمشون؟ آخه خیلی سخته

چیا؟؟؟
واکنش ها تو کتاب مهما ولی دوساله که تو کنکور واکنش دادن
ولی شما باید واکنش های مهم کتاب بلد باشین که اگه تمرین زیاد کنین توذهنتون میمونه@kosar-mottaghi همین واکنشا آخه هر سوالیو میبینی خودش داده ته تهش موازنه میخوای بکنی من فک میکردم این معلم ما کلا گیره چون جدول تناوبیو با عدد جرمیش گفت حفظ کنین الان ک میبینم اینجام حرفش هست میبینم ک چاره ای ندارم اینم حفظ میکنم دیگه


-
@kosar-mottaghi همین واکنشا آخه هر سوالیو میبینی خودش داده ته تهش موازنه میخوای بکنی من فک میکردم این معلم ما کلا گیره چون جدول تناوبیو با عدد جرمیش گفت حفظ کنین الان ک میبینم اینجام حرفش هست میبینم ک چاره ای ندارم اینم حفظ میکنم دیگه


Fa Fa در شیمی طوری



 گفته است:
گفته است:@kosar-mottaghi همین واکنشا آخه هر سوالیو میبینی خودش داده ته تهش موازنه میخوای بکنی من فک میکردم این معلم ما کلا گیره چون جدول تناوبیو با عدد جرمیش گفت حفظ کنین الان ک میبینم اینجام حرفش هست میبینم ک چاره ای ندارم اینم حفظ میکنم دیگه


تا عدداتمی۳۶ حفظ میکنین خیلی استفاده کنین یادتون میمونه منم اول فک میکردم سخته
-
Nadiya ooo در شیمی طوری



 گفته است:
گفته است:سلام
مطالبتون خیلی خوب بود مخصوصا کلسترول
اگ اگ از گروه های امینی دیگ هم جمع بندی ایطوری دارین
ممنونت میشم بزاری
سلام چشم حتما

@kosar-mottaghi مرسیتم

-
Fa Fa در شیمی طوری



 گفته است:
گفته است:@kosar-mottaghi همین واکنشا آخه هر سوالیو میبینی خودش داده ته تهش موازنه میخوای بکنی من فک میکردم این معلم ما کلا گیره چون جدول تناوبیو با عدد جرمیش گفت حفظ کنین الان ک میبینم اینجام حرفش هست میبینم ک چاره ای ندارم اینم حفظ میکنم دیگه


تا عدداتمی۳۶ حفظ میکنین خیلی استفاده کنین یادتون میمونه منم اول فک میکردم سخته
@kosar-mottaghi اول مدرسه کلشو حفظ کردیم بجز واسطه ها دیگه کار از کار گذشته


-
 واکنش اسیدها با بازها
واکنش اسیدها با بازها
 اگر اسید و باز باهم مخلوط شوند همدیگر را خنثی می کنند به این واکنش خنثی شدن می گویند.
اگر اسید و باز باهم مخلوط شوند همدیگر را خنثی می کنند به این واکنش خنثی شدن می گویند. از واکنش اسید با باز، نمک و آب تولید می شود. (کاتیون نمک از باز و آنیون آن از اسید است)
از واکنش اسید با باز، نمک و آب تولید می شود. (کاتیون نمک از باز و آنیون آن از اسید است) اگر اسید و باز هر دو یک ظرفیتی باشند (مثل HCl و NaOH)، در واکنش خنثی شدن ضریب هر دو برابر خواهد بود و از لحاظ مولی اگر باهم برابر باشند pH نهایی محلول ۷ خواهد بود یعنی خنثی. اگر مول اسید بیشتر باشد مقداری از اسید خنثی نشده در محلول باقی می ماند و محلول اسیدی خواهد بود. اگر مول باز بیشتر باشد مقداری از باز خنثی نشده در محلول باقی می ماند محلول بازی خواهد بود.
اگر اسید و باز هر دو یک ظرفیتی باشند (مثل HCl و NaOH)، در واکنش خنثی شدن ضریب هر دو برابر خواهد بود و از لحاظ مولی اگر باهم برابر باشند pH نهایی محلول ۷ خواهد بود یعنی خنثی. اگر مول اسید بیشتر باشد مقداری از اسید خنثی نشده در محلول باقی می ماند و محلول اسیدی خواهد بود. اگر مول باز بیشتر باشد مقداری از باز خنثی نشده در محلول باقی می ماند محلول بازی خواهد بود. اگر باز دو ظرفیتی باشد مثل Mg(OH)2، برای خنثی شدن کامل آن باید مول اسید دوبرابر آن باشد و در واکنش موازنه شده هم ضریب اسید دوبرابر آن خواهد بود. و برای اسیدها هم برعکس.
اگر باز دو ظرفیتی باشد مثل Mg(OH)2، برای خنثی شدن کامل آن باید مول اسید دوبرابر آن باشد و در واکنش موازنه شده هم ضریب اسید دوبرابر آن خواهد بود. و برای اسیدها هم برعکس. اساس کار ضداسیدها بر مبنای خنثی شدن اسید با باز است. معده وقتی اسیدی می شود برای خنثی کردن آن از یک ضد اسید استفاده می کنیم . ضداسیدها خاصیت بازی دارند.
اساس کار ضداسیدها بر مبنای خنثی شدن اسید با باز است. معده وقتی اسیدی می شود برای خنثی کردن آن از یک ضد اسید استفاده می کنیم . ضداسیدها خاصیت بازی دارند. -
 پدیده اسمز و اسمز معکوس
پدیده اسمز و اسمز معکوس
 ️اسمز فرآیندی است که در آن مولکولهای حلال با عبور از غشای نیمه تراوا از محلول رقیق تر و یا حلال خالص به محلول غلیظ تر مهاجرت می کنند.
️اسمز فرآیندی است که در آن مولکولهای حلال با عبور از غشای نیمه تراوا از محلول رقیق تر و یا حلال خالص به محلول غلیظ تر مهاجرت می کنند. ️اسمز معکوس فرآیندی است که با اعمال نیرو بر سطح محلول مولکولهای آب از سمت محلول به سمت حلال خالص مهاجرت می کنند و این برعکس پدیده اسمز است.
️اسمز معکوس فرآیندی است که با اعمال نیرو بر سطح محلول مولکولهای آب از سمت محلول به سمت حلال خالص مهاجرت می کنند و این برعکس پدیده اسمز است. ️چند مورد از تفاوتهای اسمز با اسمز معکوس:
️چند مورد از تفاوتهای اسمز با اسمز معکوس: اسمر بصورت خودبخودی صورت می گیرد ولی اسمز معکوس غیرخودبخودی است و نیاز به فشار و اعمال نیروی بیرونی دارد.
اسمر بصورت خودبخودی صورت می گیرد ولی اسمز معکوس غیرخودبخودی است و نیاز به فشار و اعمال نیروی بیرونی دارد. در اسمز مولکولهای آب از قسمت رقیق به قسمت غلیظ حرکت می کنند ولی در اسمز معکوس برعکس آن اتفاق می افتد.
در اسمز مولکولهای آب از قسمت رقیق به قسمت غلیظ حرکت می کنند ولی در اسمز معکوس برعکس آن اتفاق می افتد. در اسمز محلول غلیظ، رقیق تر می شود اما در اسمز معکوس محلول غلیظ، غلیظ تر می شود.
در اسمز محلول غلیظ، رقیق تر می شود اما در اسمز معکوس محلول غلیظ، غلیظ تر می شود. با روش اسمز معکوس می توان آب دریا را شیرین کرد ولی با روش اسمز این کار امکان پذیر نیست.
با روش اسمز معکوس می توان آب دریا را شیرین کرد ولی با روش اسمز این کار امکان پذیر نیست. -
 دسته بندی محلولها برحسب تفکیک
دسته بندی محلولها برحسب تفکیک
 الکترولیت قوی
الکترولیت قوی
 انحلال: یونی
انحلال: یونی
 درصد تفکیک: 100 درصد
درصد تفکیک: 100 درصد
 رسانایی الکتریکی: قوی
رسانایی الکتریکی: قوی
 مثال: اسید و بازهای قوی مثل HCl و KOH و نمکهای محلول مثل NaCl و KNO3
مثال: اسید و بازهای قوی مثل HCl و KOH و نمکهای محلول مثل NaCl و KNO3 الکترولیت ضعیف
الکترولیت ضعیف
 انحلال: عمدتا مولکولی و اندکی یونی
انحلال: عمدتا مولکولی و اندکی یونی
 درصد تفکیک: اندک
درصد تفکیک: اندک
 رسانایی: ضعیف
رسانایی: ضعیف
 مثال: اسید و بازهای ضعیف مثل HF و NH3
مثال: اسید و بازهای ضعیف مثل HF و NH3 غیرالکترولیت
غیرالکترولیت
 انحلال: مولکولی
انحلال: مولکولی
 درصد تفکیک: کمتر از 10%
درصد تفکیک: کمتر از 10%
 رسانایی الکتریکی: نارسانا
رسانایی الکتریکی: نارسانا
 مثال: ترکیبهای مولکولی مثل شکر، اتانول، استون و ...
مثال: ترکیبهای مولکولی مثل شکر، اتانول، استون و ... -
 نقطه جوش ترکیبات هیدروژندار
نقطه جوش ترکیبات هیدروژندار
نقطه ذوب و جوش ترکیبات مولکولی به نیروی بین مولکولی بستگی دارد. در مولکولهای ناقطبی هر چه جرم مولکول بیشتر باشد نیروی بین مولکولی بیشتر است. اگر مولکول توانایی تشکیل پیوند هیدروژنی داشته باشد نیروی بین مولکولی در آن خیلی قویتر بوده و بر جرم مولکولی غالب است
 ️گروه۱۴
️گروه۱۴
SnH4 > GeH4 > SiH4 > CH4 ️گروه۱۵
️گروه۱۵
SbH3 > NH3 > AsH3 > PH3 ️گروه۱۶
️گروه۱۶
H2O > H2Te > H2Se > H2S ️گروه۱۷
️گروه۱۷
HF > HI > HBr > HClعلت شکست، تشکیل پیوند هیدروژنی بین مولکولها است.
-
 ️هیدروکربنهای حلقوی
️هیدروکربنهای حلقوی ️
️ ️هیدروکربن های حلقوی را می توان به دو دسته آروماتیک و غیرآروماتیک تقسیم کرد.
️هیدروکربن های حلقوی را می توان به دو دسته آروماتیک و غیرآروماتیک تقسیم کرد. ️از هیدورکربن های آروماتیک می توان به بنزن و نفتالن اشاره کرد.
️از هیدورکربن های آروماتیک می توان به بنزن و نفتالن اشاره کرد. ️از هیدروکربن های غیرآروماتیک می توان به سیکلوآلکان و سیکلوآلکن اشاره کرد.
️از هیدروکربن های غیرآروماتیک می توان به سیکلوآلکان و سیکلوآلکن اشاره کرد. ️سرگروه خانواده آروماتیک ها، بنزن است. فرمول مولکولی بنزن C6H6 است.
️سرگروه خانواده آروماتیک ها، بنزن است. فرمول مولکولی بنزن C6H6 است. ️فرمول مولکولی نفتالن C10H8 بوده و در گذشته بعنوان ضد بید برای نگهداری فرش و لباس کاربرد داشت.
️فرمول مولکولی نفتالن C10H8 بوده و در گذشته بعنوان ضد بید برای نگهداری فرش و لباس کاربرد داشت. ️هیدروکربنهای آروماتیک فرمول عمومی مشخصی ندارند.
️هیدروکربنهای آروماتیک فرمول عمومی مشخصی ندارند. ️فرمول عمومی سیکلوآلکانها CnH2n بوده و با آلکن ها ایزومر ساختاری هستند.
️فرمول عمومی سیکلوآلکانها CnH2n بوده و با آلکن ها ایزومر ساختاری هستند. ️معروفترین سیکلوآلکان، سیکلوهگزان با فرمول C6H12 است.
️معروفترین سیکلوآلکان، سیکلوهگزان با فرمول C6H12 است.
دانش-آموزان-نظام-جدید-آلا
بچه-های-کنکور-تجربی-1400 -
 ثابت یونش اسید و درجه یونش
ثابت یونش اسید و درجه یونش  :
:1)به فرایندی که در آن از مولکول ، یون های مثبت و منفی به دست آید یونش می گویند و با علامت آلفا آن را نمایش میدهند.
2)یونش اسید ها را به اختصار درجه یونش میگویند.
3)درجه یونش عبارت است از نسبت یون های یونیده شده به کل یونها.
4)ثابت یونش به میزان پیشرفت واکنش تا رسیدن به تعادل واکنش را نشان میدهد.
5)ثابت تعادل عبارت است از نسبت حاصلضرب غلظت های تعادلی به غلظت تعادلی اسید .
6)برای یک واکنش واکنش تعادلیkمقداری ثابت است
7)قدرت اسید باkرابطه ای مستقیم دارد، یعنی هرچه kبزرگتر باشه ، اسید قویتر است.
-
#شیمی
 نکات ناب جدول تناوبی
نکات ناب جدول تناوبی1_تناوب هایی که فقط جامد و گاز دارد =2؛3؛5
2_تناوبی که جامد و گاز دارد=2؛3؛4؛5؛6
3_تناوب هایی که فقط یک حالت ماده را دارد =1؛7
4_تناوبی که هر سه حالت مایع و جامد و گاز را دارد =4؛6
5_گروه هایی که هر سه حالت ماده را دارند =17
6_گروه هایی که جامد و مایع در آن وجود دارد=12 و17
7_گروهی که فقط جامد و مایع در آن دیده میشود=12
8_گروه هایی که فلز و نافلز و شبه فلز در آن دیده میشود =14 و 15
9_گروهی که فقط شبه فلز و فلز در آن دیده میشود =13
10_ گروهی که فقط نافلز در آن دیده میشود =18
11_گروهی که فقط فلز و نافلز در آن دیده میشود =1
12_ گروه هایی که نافلز و فلز در آن دیده میشود=1؛14؛15
13_گروه هایی که گاز در آن دیده میشود =1؛15؛16؛17؛18
14_تناوب 2 و 3 هر کدام 1 و 5؛4 هرکدام 2 شبه فلز دارند
دانش-آموزان-نظام-جدید-آلا -
۱ - زمین خانه ماست و سرشار از نعمت ها و هدایای پیدا و ناپیدای گوناگون است که هر یک اندازه معینی دارد .
۲ - هدایایی که با انسان با بهره گیری و شناخت از آنها توانسته است با ساختن ابزار و دستگاه ها به همه نقاط کره زمین سفر کند .
۳ - توانایی انسان در بیرون کشیدن موادی مانند نفت و فلزها به او این امکان را داده است تا سرپناهی ایمن و گرم برای زندگی خود فراهم سازد .
۴ - دانش شیمی کمک می کند تا ساختار دقیق این هدایا را شناسایی و به رفتار آنها پی ببریم و بهره برداری درست را بیاموزیم .
۵ - صنایع گوناگون مانند غذا ، پوشاک ، حمل و نقل و ... تحت تاثیر مواد قرار دارند .
۶ - رشد و گسترش تمدن بشری در گرو کشف و شناخت مواد جدید است .
۷ - توسعه جوامع انسانی به توانمندی افراد هوشمند گره خورده که برای رفع نیازهای خود و جامعه موادی تولید کرده ، یا با دستکاری مواد خواص آنها را تغییر داده اند .
۸ - گرما دادن به مواد و افزودن آنها به یکدیگر سبب تغییر و گاهی بهبود خواص مواد می شود .
۹ - گسترش فناوری به میزان دسترسی به مواد مناسب وابسته است .
۱۰ - گسترش صنعت خودرو مدیون شناخت و دسترسی به فولاد است .
۱۱ - پیشرفت صنعت الکترونیک بر اجزایی استوار است که از موادی به نام نیمه رساناها ساخته می شوند .
۱۲ - همه مواد طبیعی و مصنوعی از کره زمین به دست می آیند .
۱۳ - میزان مصرف :
مواد معدنی > سوخت های فسیلی > فلزها
۱۴ - میزان رشد مصرف استفاده :
فلزات > مواد معدنی > سوخت فسیلی
۱۵ - زندگی روزانه ما به منابع شیمیایی وابسته است .
-
- گیاهان با استفاده از کودهای شیمیایی پتاسیم ، نیتروژن و فسفر دار رشد کرده اند .
۱۷ - پراکندگی منابع شیمیایی در همه جای زمین یکسان نیست و همین مطلب می تواند سبب پیدایش تجارت جهانی باشد .
۱۸ - دانشمندان برجسته و بزرگ ، دانشمندانی هستند که می توانند با بررسی دقیق اطلاعات و یافته های موجود درباره مواد و پدیده های گوناگون ، الگوها ، روندها و روابط بین آنها را درک کرده و توضیح دهند .
۱۹ - مندلیف یکی از دانشمندان برجسته است.
۲۰ - شیمی دان ها با مشاهده مواد و انجام آزمایش های گوناگون آنها را دقیق بررسی می کنند .
۲۱ - برقراری ارتباط میان داده ها و اطلاعات ، همچنین یافتن الگوها و روندها گامی مهم تر و موثرتر در پیشرفت علم است .
۲۲ - علم شیمی را می توان مطالعه هدف دار ، منظم و هوشمندانه رفتار عنصرها و مواد برای یافتن روندها و الگوهای رفتار فیزیکی و شیمیایی آنها دانست .
۲۳ - جدول دوره ای ، نمایشی بی نظیر از چیدمان عنصرها است و همانند یک نقشه راه برای شیمیدان ها میباشد .
۲۴ - جدول تناوبی کمک می کند که حجم انبوهی از مشاهده ها سازمان دهی و تجزیه و تحلیل شود تا الگوهای پنهان در رفتار عنصرها آشکار شود .
۲۵ - عنصرها در جدول دوره ای بر اساس بنیادی ترین ویژگی یعنی عدد اتمی چیده شده اند .
۲۶ - عنصرهایی که در یک گروه قرار گرفته اند شمار الکترون های ظرفیت شان با هم برابر است .
۲۷ - تعیین موقعیت ( دوره و گروه) کمک شایانی به پیش بینی خواص و رفتار عنصرها خواهد کرد .
۲۸ - عنصرهای جدول تناوبی بر اساس رفتار آنها در سه دسته فلز ، نافلز و شبه فلز قرار دارند .
۲۹ - با بررسی رفتارها ضمن دسته بندی عنصرها به روندها و الگوهای موجود در خواص آنها میتوان پی برد .
۳۰ - شبه فلزات عنصرهایی هستند که از لحاظ ظاهری شباهت به فلزات دارند در واقع خواص فیزیکی شبه فلزها بیشتر به فلزها شبیه است ( شبه فلزها همگی جامدند ) در حالی که رفتار شیمیایی آنها همانند نافلزات است .
-
 ️مقایسه سلولهای الکترولیتی و گالوانی:
️مقایسه سلولهای الکترولیتی و گالوانی:
 چند تفاوت از سلولهای الکترولیتی و گالوانی:
چند تفاوت از سلولهای الکترولیتی و گالوانی:1⃣در سلول گالوانی بخشی از انرژی شیمیایی به انرژی الکتریکی تبدیل میشود اما در در سلول الکترولیتی،انرژی الکتریکی به انرژی شیمیایی تبدیل میشود.
2⃣در سلول گالوانی،الکترود آند قطب منفی و الکترود کاتد قطب مثبت است.
اما در سلول الکترولیتی آند قطب مثبت و کاتد قطب منفی است.3⃣در سلول گالوانی،جهت حرکت الکترونها از قطب منفی به سمت قطب مثبت است.
4⃣در سلول گالوانی،واکنش در جهت طبیعی و خودبهخودی است.
اما در سلول الکترولیتی،واکنش در خلاف جهت طبیعی و به طور غیرخودبهخودی است. چند شباهت از سلولهای گالوانی و الکترولیتی:
چند شباهت از سلولهای گالوانی و الکترولیتی: در هر دو نوع سلول،در آند نیمواکنش اکسایش و در کاتد نیمواکنش کاهش صورت میگیرد.
در هر دو نوع سلول،در آند نیمواکنش اکسایش و در کاتد نیمواکنش کاهش صورت میگیرد. در الکترولیت هر دو نوع سلول،جهت حرکت آنیونها به سمت آند و جهت حرکت کاتیونها به سمت کاتد است.
در الکترولیت هر دو نوع سلول،جهت حرکت آنیونها به سمت آند و جهت حرکت کاتیونها به سمت کاتد است. در هر دو نوع سلول،جهت حرکت الکترونها در مدار بیرونی (رسانای الکترونی) از آند به کاتد است.
در هر دو نوع سلول،جهت حرکت الکترونها در مدار بیرونی (رسانای الکترونی) از آند به کاتد است. -
1⃣روند تغییر خصلت فلزی و نافلزی:
 میتوان گفت هرچه یک عنصر راحتتر الکترون از دست بدهد،خصلت فلزی بیشتری دارد.
میتوان گفت هرچه یک عنصر راحتتر الکترون از دست بدهد،خصلت فلزی بیشتری دارد.
همچنین برای نافلزات نیز میتوان گفت هرچه یک عنصر راحتتر الکترون دریافت کند،خصلت نافلزی بیشتری دارد. در هر دوره از جدول تناوبی(به جز دوره اول)از سمت چپ به راست،خصلت فلزی عنصرها به تدریج کاهش یافته و بر خصلت نافلزی آنها افزوده میشود.
در هر دوره از جدول تناوبی(به جز دوره اول)از سمت چپ به راست،خصلت فلزی عنصرها به تدریج کاهش یافته و بر خصلت نافلزی آنها افزوده میشود. اما در هر گروه از جدول تناوبی از بالا به پایین،خصلت فلزی عنصرها افزایش و خصلت نافلزی آنها کاهش مییابد.
اما در هر گروه از جدول تناوبی از بالا به پایین،خصلت فلزی عنصرها افزایش و خصلت نافلزی آنها کاهش مییابد. نکته:آخرین عنصر موجود در هر تناوب،یک گاز نجیب است.گازهای نجیب عنصرهایی هستند که میل ترکیبی ندارند و یا میل ترکیبی آنها بسیار اندک است.
نکته:آخرین عنصر موجود در هر تناوب،یک گاز نجیب است.گازهای نجیب عنصرهایی هستند که میل ترکیبی ندارند و یا میل ترکیبی آنها بسیار اندک است.2⃣شعاع اتمی:
 شعاع اتمی عنصرها در یک گروه از بالا به پایین با افزایش عدد اتمی افزایش مییابد.
شعاع اتمی عنصرها در یک گروه از بالا به پایین با افزایش عدد اتمی افزایش مییابد. همچنین در یک دوره،شعاع اتمی عنصرها از چپ به راست کاهش مییابد.
همچنین در یک دوره،شعاع اتمی عنصرها از چپ به راست کاهش مییابد. نکته:در یک دوره بیشترین شعاع اتمی مربوط به عناصر گروه یک و کمترین شعاع اتمی با چشمپوشی از گازهای نجیب مربوط به عناصر گروه هفده(هالوژنها) میباشد.
نکته:در یک دوره بیشترین شعاع اتمی مربوط به عناصر گروه یک و کمترین شعاع اتمی با چشمپوشی از گازهای نجیب مربوط به عناصر گروه هفده(هالوژنها) میباشد.3⃣واکنشپذیری عنصرها:
 فلزها:
فلزها: در گروه یک،از بالا به پایین با افزایش شعاع اتمی،عنصر فلزی راحتتر الکترون از دست داده و در نتیجه خصلت فلزی و واکنشپذیری آنها افزایش مییابد.
در گروه یک،از بالا به پایین با افزایش شعاع اتمی،عنصر فلزی راحتتر الکترون از دست داده و در نتیجه خصلت فلزی و واکنشپذیری آنها افزایش مییابد. به طور کلی در یک دوره از چپ به راست،با کاهش شعاع اتمی،تمایل فلزی برای از دست دادن الکترون کم شده و خصلت فلزی و واکنشپذیری کاهش مییابد.
به طور کلی در یک دوره از چپ به راست،با کاهش شعاع اتمی،تمایل فلزی برای از دست دادن الکترون کم شده و خصلت فلزی و واکنشپذیری کاهش مییابد. نافلزها:
نافلزها: اما در گروههای نافلزی از بالا به پایین با افزایش سعاع اتمی،تمایل به دریافت الکترون و درنتیجه خصلت نافلزی و واکنشپذیری کاهش مییابد.
اما در گروههای نافلزی از بالا به پایین با افزایش سعاع اتمی،تمایل به دریافت الکترون و درنتیجه خصلت نافلزی و واکنشپذیری کاهش مییابد. همچنین به طور کلی در هر دوره از چپ به راست،با کاهش شعاع اتمی،تمایل عنصر نافلزی به گرفتن الکترون و درنتیجه خصلت نافلزی و واکنشپذیری افزایش مییابد.
همچنین به طور کلی در هر دوره از چپ به راست،با کاهش شعاع اتمی،تمایل عنصر نافلزی به گرفتن الکترون و درنتیجه خصلت نافلزی و واکنشپذیری افزایش مییابد.بچه-های-کنکور-ریاضی-1400
بچه-های-کنکور-تجربی-1400
تجربیا
ریاضیا -
 نمکهای نامحلول در آب (کنکوری)
نمکهای نامحلول در آب (کنکوری)
 ️تمامی سولفیدها در آب نامحلولند به جز:
️تمامی سولفیدها در آب نامحلولند به جز:
سولفیدهای فلزات قلیایی و قلیایی خاکی و آمونیوم ️تمامی اکسیدها در آب نامحلولند به جز:
️تمامی اکسیدها در آب نامحلولند به جز:
اکسیدهای فلزات قلیایی و CaO, BaO , SrO ️تمامی کربناتها در آب نامحلولند به جز:
️تمامی کربناتها در آب نامحلولند به جز:
کربناتهای فلزات قلیایی و آمونیوم ️تمامی سولفیتها در آب نامحلولند به جز:
️تمامی سولفیتها در آب نامحلولند به جز:
سولفیت فلزات قلیایی و آمونیوم ️تمامی فسفاتها در آب نامحلولند به جز:
️تمامی فسفاتها در آب نامحلولند به جز:
فسفات فلزات قلیایی و آمونیوم ️تمامی هیدروکسیدها در آب نامحلولند به جز:
️تمامی هیدروکسیدها در آب نامحلولند به جز:
هیدروکسید فلزات قلیایی و Ba(OH)2, Sr(OH)2, Ca(OH)2 -
 ویژگی های منحصر بفرد فلز طلا
ویژگی های منحصر بفرد فلز طلا
 ️چکش خواری و نرمی زیاد
️چکش خواری و نرمی زیاد ️رسانایی الکتریکی زیاد
️رسانایی الکتریکی زیاد ️حفظ رسانایی الکتریکی در شرایط دمایی گوناگون
️حفظ رسانایی الکتریکی در شرایط دمایی گوناگون ️واکنش ندادن با گازهای موجود در هواکره
️واکنش ندادن با گازهای موجود در هواکره ️واکنش ندادن با مواد موجود در بدن انسان
️واکنش ندادن با مواد موجود در بدن انسان ️بازتابش زیاد پرتوهای خورشیدی
️بازتابش زیاد پرتوهای خورشیدی توجه کنید: طلا واکنش پذیری کمی دارد و با گازهای هواکره و مواد موجود در بدن واکنش نمی دهد ولی این گفته بدین معنی نیست که طلا واکنش ناپذیر است و اصلا واکنش نمی دهد! طلا در شرایط خاصی می تواند با مواد دیگر واکنش دهد و یونها و ترکیبات یونی و کمپلکسهای زیادی بوجود آورد.
توجه کنید: طلا واکنش پذیری کمی دارد و با گازهای هواکره و مواد موجود در بدن واکنش نمی دهد ولی این گفته بدین معنی نیست که طلا واکنش ناپذیر است و اصلا واکنش نمی دهد! طلا در شرایط خاصی می تواند با مواد دیگر واکنش دهد و یونها و ترکیبات یونی و کمپلکسهای زیادی بوجود آورد. -
 مقایسه اوزون با مولکول اکسیژن
مقایسه اوزون با مولکول اکسیژن
 اوزون یکی از آلوتروپهای اکسیژن، سه اتمی O3 ولی اکسیژن دو اتمی O2 است.
اوزون یکی از آلوتروپهای اکسیژن، سه اتمی O3 ولی اکسیژن دو اتمی O2 است. اوزون سنگین تر از اکسیژن است در نتیجه چگالی آن نیز بیشتر خواهد بود.
اوزون سنگین تر از اکسیژن است در نتیجه چگالی آن نیز بیشتر خواهد بود. نقطه جوش اوزون بالاتر از اکسیژن است.
نقطه جوش اوزون بالاتر از اکسیژن است. اوزون قطبی ولی اکسیژن ناقطبی است.
اوزون قطبی ولی اکسیژن ناقطبی است. واکنش پذیری اوزون بیشتر از اکسیژن است.
واکنش پذیری اوزون بیشتر از اکسیژن است. اوزون سه پیوند و ۶ جفت الکترون ناپیوندی دارد. اکسیژن دو پیوند و ۴ جفت الکترون ناپیوندی دارد.
اوزون سه پیوند و ۶ جفت الکترون ناپیوندی دارد. اکسیژن دو پیوند و ۴ جفت الکترون ناپیوندی دارد. -
 کدام پیوندها یونی نیستند
کدام پیوندها یونی نیستند
 ️بریلیم (Be) اگرچه یک فلز قلیایی خاکی است اما تا حدودی خصلت نافلزی دارد و ترکیب آن با نافلزات خاصیت کووالانسی دارد و پیوند آن با نافلزات، یونی محسوب نمی شود مثل BeCl2
️بریلیم (Be) اگرچه یک فلز قلیایی خاکی است اما تا حدودی خصلت نافلزی دارد و ترکیب آن با نافلزات خاصیت کووالانسی دارد و پیوند آن با نافلزات، یونی محسوب نمی شود مثل BeCl2 ️هالیدهای آلومینیوم به جز AlF3 پیوند کوالانسی دارند و ترکیب یونی محسوب نمی شوند مثل AlCl3، AlBr3
️هالیدهای آلومینیوم به جز AlF3 پیوند کوالانسی دارند و ترکیب یونی محسوب نمی شوند مثل AlCl3، AlBr3( آلومینیوم اکسید Al2O3 یونی است.)
 ️بور (B) و (Si) شبه فلز هستند و پیوند آنها با نافلزات یونی نیست مثل BF3
️بور (B) و (Si) شبه فلز هستند و پیوند آنها با نافلزات یونی نیست مثل BF3 ️ترکیب بعضی فلزات واسطه با اکسیژن، کلر ... اغلب مولکولی محسوب می شوند مثلا Fe2O3, TiO2 هر چند در نامگذاری ممکن است بصورت ترکیبات یونی نامگذاری شوند.
️ترکیب بعضی فلزات واسطه با اکسیژن، کلر ... اغلب مولکولی محسوب می شوند مثلا Fe2O3, TiO2 هر چند در نامگذاری ممکن است بصورت ترکیبات یونی نامگذاری شوند.
بچه-های-کنکور-ریاضی-1400
بچه-های-کنکور-تجربی-1400
تجربیا
ریاضیا

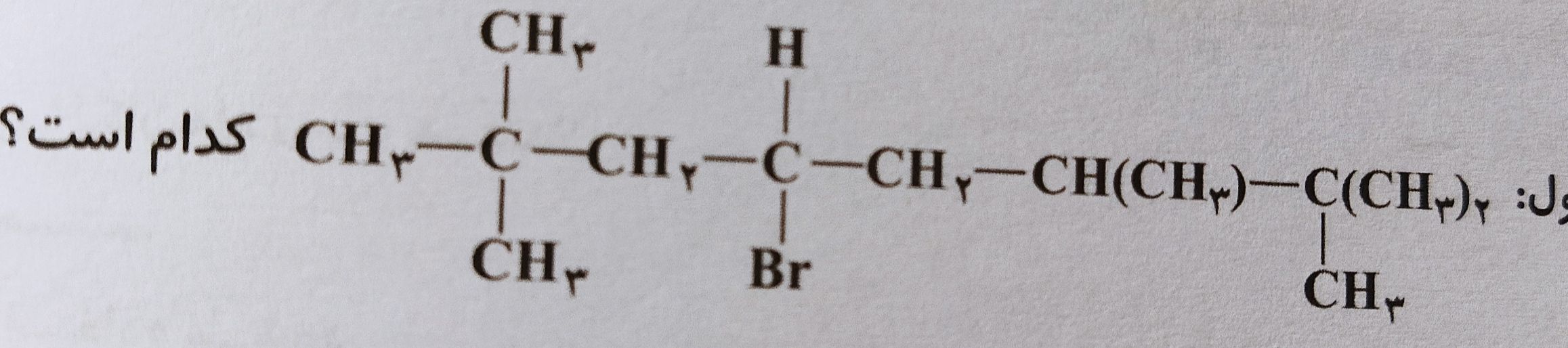
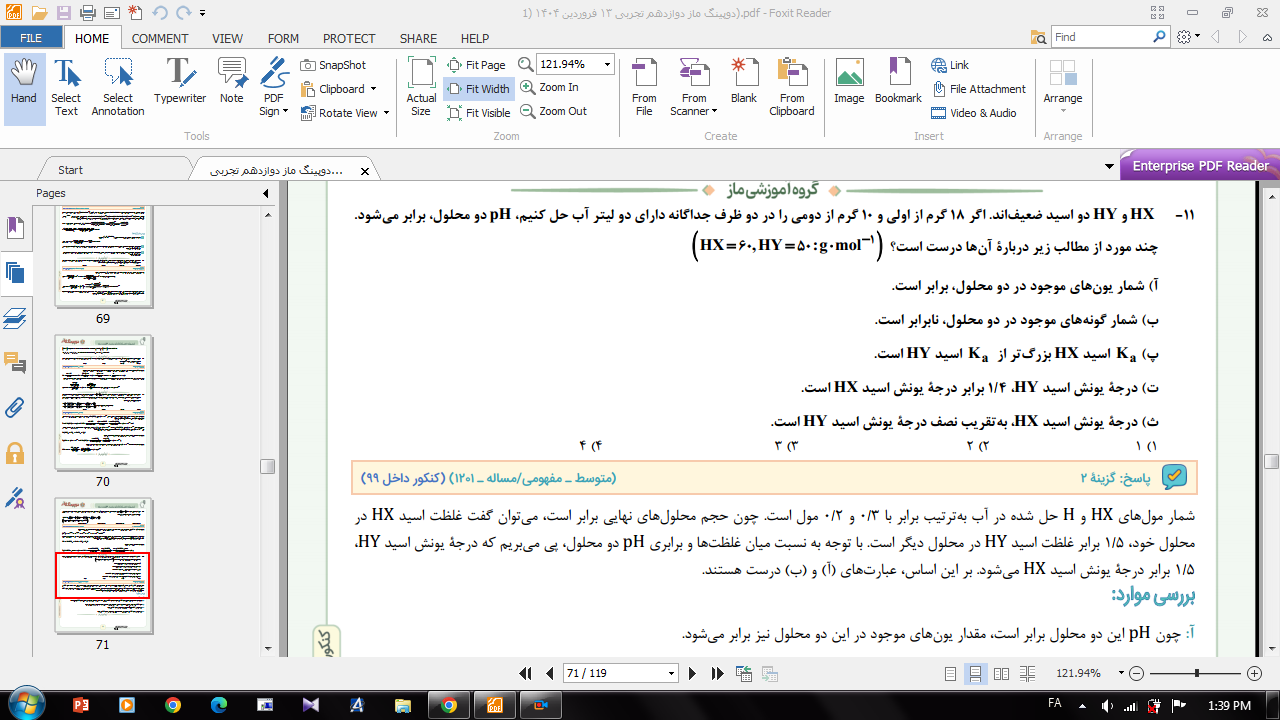
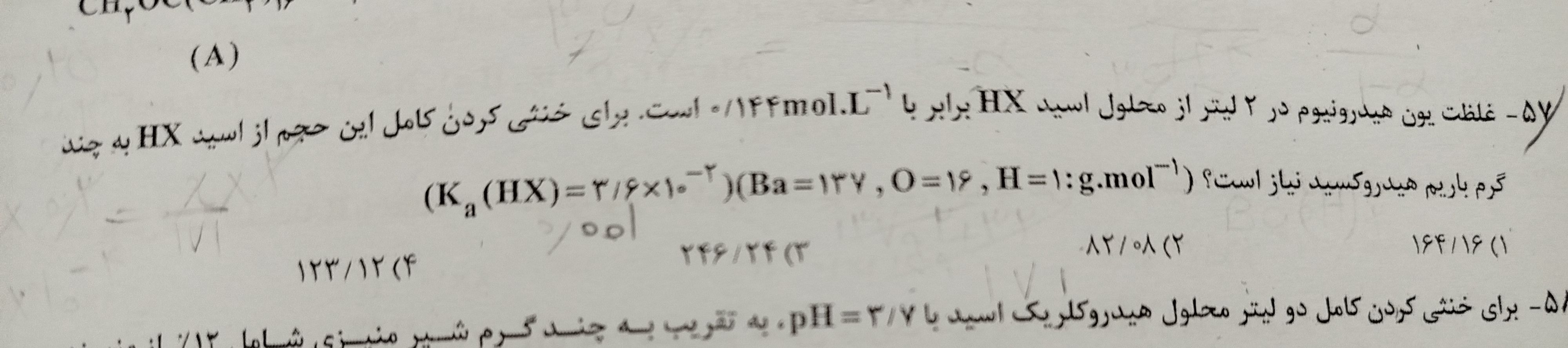
 روش دیدن فیلم آموزشی کلاس های سالیانه و روش مطالعه ی شیمی 🧪
روش دیدن فیلم آموزشی کلاس های سالیانه و روش مطالعه ی شیمی 🧪