انحلال پذیری اوریک اسید
-
پیوند قطبی داره ولی اینا که اونقدر قطبیت پیوندشون زیاد نیست(اختلاف الکترونگاتیوی دو عنصر در گیر تو پیوندای مواد آلی زیاد نیست برخلاف یونها!!) اونقدری نیست که مثلا مولکول آب بخواد کلا اینا رو جدا کنه از هم....تو ترکیبات یونی کلا می کنه می بره اون ور...
ولی گروه های عاملیش(مثل اتری و آمیدی) در کل کمی باعث انحلال پذیریش می شن یعنی تا حدودی با مولکولهای آب پیوند هیدروژنی برقرار می کنن....(ولی این پیوند هیدروژنی جاذبه ی ضعیفیه و اصلا نمی تونه بر پیوند کوالانسی بین اتمی قوی اتمهای ساختار غلبه کنه....!)
حله داداش؟! -
پیوند قطبی داره ولی اینا که اونقدر قطبیت پیوندشون زیاد نیست(اختلاف الکترونگاتیوی دو عنصر در گیر تو پیوندای مواد آلی زیاد نیست برخلاف یونها!!) اونقدری نیست که مثلا مولکول آب بخواد کلا اینا رو جدا کنه از هم....تو ترکیبات یونی کلا می کنه می بره اون ور...
ولی گروه های عاملیش(مثل اتری و آمیدی) در کل کمی باعث انحلال پذیریش می شن یعنی تا حدودی با مولکولهای آب پیوند هیدروژنی برقرار می کنن....(ولی این پیوند هیدروژنی جاذبه ی ضعیفیه و اصلا نمی تونه بر پیوند کوالانسی بین اتمی قوی اتمهای ساختار غلبه کنه....!)
حله داداش؟!MohsenTaheri
مرسی بابت نظر
ولی پیوند های CO و NH چطور قطبیت پیوندشون زیاد نیست؟ گشتاور دوقطبیشون که بالاست... -
MohsenTaheri
مرسی بابت نظر
ولی پیوند های CO و NH چطور قطبیت پیوندشون زیاد نیست؟ گشتاور دوقطبیشون که بالاست...Saudade 19 0 تو جدولی که پاولینگ برای اندازه گیری نسبی الکترونگاتیوی عناصر ارائه کرد عدد الکترونگاتیوی نسبی عناصر کربن، اکسیژن و نیتروژن به ترتیب زیرند:
2.5 کربن
3.5 اکسیژن
3 نیتروژن
اختلاف اینا رو بگیری هیچ کدوم از 1.4 بالاتر نمی رن....یعنی پیوند درسته قطبی هست ولی یونی نیست....وقتی هم یون تشکیل نشه ینی انحلال پذیری مولکولی بود....ولی از طرفی همه ی مولکول ها حل نمی شن و 100 هم تفکیکی تو کار نیست!!
انحلال پذیری اوریک اسید کمه... -
اوریک اسید بخش عمده ش ناقطبیه پس تو حلال های ناقطبی(آلی) مث اتانول یا تینر یا هگزان و... به خوبی حل خواهد شد....ولی تو آب ن زیاد
-
Saudade 19 0 تو جدولی که پاولینگ برای اندازه گیری نسبی الکترونگاتیوی عناصر ارائه کرد عدد الکترونگاتیوی نسبی عناصر کربن، اکسیژن و نیتروژن به ترتیب زیرند:
2.5 کربن
3.5 اکسیژن
3 نیتروژن
اختلاف اینا رو بگیری هیچ کدوم از 1.4 بالاتر نمی رن....یعنی پیوند درسته قطبی هست ولی یونی نیست....وقتی هم یون تشکیل نشه ینی انحلال پذیری مولکولی بود....ولی از طرفی همه ی مولکول ها حل نمی شن و 100 هم تفکیکی تو کار نیست!!
انحلال پذیری اوریک اسید کمه...MohsenTaheri
co دو گانه داده و صرفا با اختلاف الکترونگاتیوی نمیشه گشتاورش رو گفت
تو مبتکران هم گفته co (دوگانه) یه پیوند شدیدا قطبی هست. NH هم که بحثش معلومه اختلاف الکترونگاتیوی و زاویه پیوند و اینا نشون میده چقدر قطبیه...و ما چندین تا از این پیوندا داریم تو ترکیب نه یکی دو تا.
ثانیا اکثر این پیوند ها به عنوان مثال تو مولکول اوره هم هست. پس چرا اوره به اون خوبی در آب حل میشه ولی اوریک اسید نه؟
بنظر من نمیشه گفت این پیوند ها قطبیتشون کمه..اشکال کار از یه جای دیگس.. -
اوریک اسید بخش عمده ش ناقطبیه پس تو حلال های ناقطبی(آلی) مث اتانول یا تینر یا هگزان و... به خوبی حل خواهد شد....ولی تو آب ن زیاد
MohsenTaheri
ببین ما کلا تو ترکیب 2 تا پیوند ناقطبی داریم...بقیش قطبی هست که حالا بعضیاشون قطبیت پیوند خیلی بالا نیست ولی 7 8 تا پیوند هست که شدیدا قطبی ان -
MohsenTaheri
co دو گانه داده و صرفا با اختلاف الکترونگاتیوی نمیشه گشتاورش رو گفت
تو مبتکران هم گفته co (دوگانه) یه پیوند شدیدا قطبی هست. NH هم که بحثش معلومه اختلاف الکترونگاتیوی و زاویه پیوند و اینا نشون میده چقدر قطبیه...و ما چندین تا از این پیوندا داریم تو ترکیب نه یکی دو تا.
ثانیا اکثر این پیوند ها به عنوان مثال تو مولکول اوره هم هست. پس چرا اوره به اون خوبی در آب حل میشه ولی اوریک اسید نه؟
بنظر من نمیشه گفت این پیوند ها قطبیتشون کمه..اشکال کار از یه جای دیگس..Saudade 19 0 داداش شما چرا میای این پیوندا رو جداگانه از کل مولکول درنظر می گیری؟؟ اگه قطبیت کربن دوگانه اکسیژن اونقدری زیادی چرا خود مولکول کربن مونواکسید به صورت مولکولی حل میشه تو آب ؟؟؟ چون این طول پیونداشون اونقدر کمه که غلبه بر اونا انرژی نسبتا زیادی میخواد(مرتبه ی پیوندم بالاست!)
ی روش ساده اینه بگیم اینا همشون نافلزن و تمایل ندارن یون بشن!!
اون CO دوگانه بشدت قطبی رو برو از کس دیگه ای بپرس!
ساختار اوره رو دیدی؟؟؟ دوتا امین داره که با سر مثبت آب میان تبادل هیدرونیوم می کنن(همون یون هیدروژن مثبت) و تبدیل به یون های آمونیوم میشن پس حلالیت بالایی داره... -
Saudade 19 0 داداش شما چرا میای این پیوندا رو جداگانه از کل مولکول درنظر می گیری؟؟ اگه قطبیت کربن دوگانه اکسیژن اونقدری زیادی چرا خود مولکول کربن مونواکسید به صورت مولکولی حل میشه تو آب ؟؟؟ چون این طول پیونداشون اونقدر کمه که غلبه بر اونا انرژی نسبتا زیادی میخواد(مرتبه ی پیوندم بالاست!)
ی روش ساده اینه بگیم اینا همشون نافلزن و تمایل ندارن یون بشن!!
اون CO دوگانه بشدت قطبی رو برو از کس دیگه ای بپرس!
ساختار اوره رو دیدی؟؟؟ دوتا امین داره که با سر مثبت آب میان تبادل هیدرونیوم می کنن(همون یون هیدروژن مثبت) و تبدیل به یون های آمونیوم میشن پس حلالیت بالایی داره...MohsenTaheri
:|||||||
من از شما معذرت میخوام
نمیدونم چی شمارو اینطور بهم ریخت!!
موفق باشید -
S Saudade 19 0 marked this topic as a question on
-
سلام دوستان وقت بخیر
این سوال رو تو جلسه رفع اشکال هم پرسیدم ولی دلم خواست که نظر بقیه دوستانم در این باره بدونم
خب همونطور که میدونیم طبق کتاب انحلال پذیری اوریک اسید در آب بسیار کم هست
اما اگه به شکلِ پایینِ همون صفحه دقت کنیم تو "بیشتر بدانید" فرمول مولکولی گسترده ی اوریک اسید رو کشیده که کلی پیوند قطبی داره
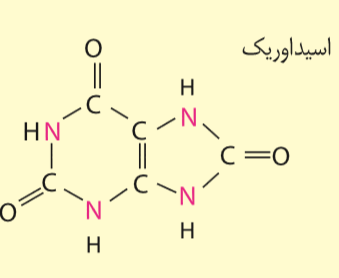
همچین چیزی چطور ممکنه..؟از دوستان کسی نبود نظر ملایم و منطقی تری داشته باشه؟:face_with_monocle:
-
-
سلام دوستان وقت بخیر
این سوال رو تو جلسه رفع اشکال هم پرسیدم ولی دلم خواست که نظر بقیه دوستانم در این باره بدونم
خب همونطور که میدونیم طبق کتاب انحلال پذیری اوریک اسید در آب بسیار کم هست
اما اگه به شکلِ پایینِ همون صفحه دقت کنیم تو "بیشتر بدانید" فرمول مولکولی گسترده ی اوریک اسید رو کشیده که کلی پیوند قطبی داره

همچین چیزی چطور ممکنه..؟Saudade 19 0
سلام
من یازدهمم شاید تو شیمی چیزی باشه که نخوندم هنوز
اما اگه ببینین اینجا پیوند هیدروژنیHوN داریم اونم تو چهار جا شاید زور آب نمیرسه اونارو بشکنه و تو خودش حل کنه
البته مطمئن نیستم زیاد🤔 -
Saudade 19 0
سلام
من یازدهمم شاید تو شیمی چیزی باشه که نخوندم هنوز
اما اگه ببینین اینجا پیوند هیدروژنیHوN داریم اونم تو چهار جا شاید زور آب نمیرسه اونارو بشکنه و تو خودش حل کنه
البته مطمئن نیستم زیاد🤔Mehrsa 14
ممنون از نظر محترمانه تون!
البته پیوند هیدروژنی یه نیروی بین مولکولی هست و در یک مولکول دیده نمیشه
و این که اتفاقا این پیوند های NH کمک میکنن که آب با این مولکول پیوند هیدروژنی ایجاد کنه و راحت تر حلش کنه (: -
Mehrsa 14
ممنون از نظر محترمانه تون!
البته پیوند هیدروژنی یه نیروی بین مولکولی هست و در یک مولکول دیده نمیشه
و این که اتفاقا این پیوند های NH کمک میکنن که آب با این مولکول پیوند هیدروژنی ایجاد کنه و راحت تر حلش کنه (:Saudade 19 0
جدا؟ چجوری کمک میکنه ممنون میشم بگین کنجکاو شدم
آخه من رو حساب اینکه پارسال گفتیم اتانول پیوند هیدروژنی داره و واسه همین از استون نقطه جوشش بیشتره و اینکه طبق کتاب آخه گفته شد موادی که در مولکولشون اتم هیدروژن به فون وصل باشن.مثل آب بین مولکولاش پیوند هیدوژنی هست تو مولکولشم H و O پیوند کووالانسی دارن ولی H با o مولکولای دیگه پیوند هیدروژنی داره. برا این همچین چیزی پیش نمیاد؟ -
Saudade 19 0
جدا؟ چجوری کمک میکنه ممنون میشم بگین کنجکاو شدم
آخه من رو حساب اینکه پارسال گفتیم اتانول پیوند هیدروژنی داره و واسه همین از استون نقطه جوشش بیشتره و اینکه طبق کتاب آخه گفته شد موادی که در مولکولشون اتم هیدروژن به فون وصل باشن.مثل آب بین مولکولاش پیوند هیدوژنی هست تو مولکولشم H و O پیوند کووالانسی دارن ولی H با o مولکولای دیگه پیوند هیدروژنی داره. برا این همچین چیزی پیش نمیاد؟Mehrsa 14
ببینید منم همین و میگم...بین مولکول ها پیوند هیدروژنی دیده میشه نه درون مولکول ها
از طرفی بنظرم پیوند هیدروژنی بین آب و اوریک اسید قوی تر از پیوند هیدروژنی بین مولکول های اوریک اسید هست...با توجه به اینکه بنظرم اطراف N الکترون دهنده های قوی ای وجود داره و به خوبی N رو تغذیه میکنه پس زیاد قوی نیست پیوندش با H ...البته اینایی که گفتم فکر کنم تو دوازدهمه -
Mehrsa 14
ببینید منم همین و میگم...بین مولکول ها پیوند هیدروژنی دیده میشه نه درون مولکول ها
از طرفی بنظرم پیوند هیدروژنی بین آب و اوریک اسید قوی تر از پیوند هیدروژنی بین مولکول های اوریک اسید هست...با توجه به اینکه بنظرم اطراف N الکترون دهنده های قوی ای وجود داره و به خوبی N رو تغذیه میکنه پس زیاد قوی نیست پیوندش با H ...البته اینایی که گفتم فکر کنم تو دوازدهمهSaudade 19 0
بله متوجه شدم ممنون. فکر کنم آخرین چیزی که گفتین مال مبحث الکترونگاتیوی باشه البته نمیدونم بازم توی سایت فرادرس انحلال پذیری ها رو دیدم و راجب اوره نوشته بود اما اسید اوریک نه.
نمی دونم واقعا چی بگم اما این سوال ذهن من هم درگیر کرد. -
Saudade 19 0
بله متوجه شدم ممنون. فکر کنم آخرین چیزی که گفتین مال مبحث الکترونگاتیوی باشه البته نمیدونم بازم توی سایت فرادرس انحلال پذیری ها رو دیدم و راجب اوره نوشته بود اما اسید اوریک نه.
نمی دونم واقعا چی بگم اما این سوال ذهن من هم درگیر کرد.Mehrsa 14
خواهش میکنم
ایشالا که یه بنده خدا جفتمون رو از این درگیری ذهنی نجات بده (: -
Mehrsa 14
خواهش میکنم
ایشالا که یه بنده خدا جفتمون رو از این درگیری ذهنی نجات بده (:Saudade 19 0
انشاالله:) -
MohsenTaheri
:|||||||
من از شما معذرت میخوام
نمیدونم چی شمارو اینطور بهم ریخت!!
موفق باشیدSaudade 19 0 معذرت واسه چی؟؟
من بهم ریختنامو گذاشتم برای جاهای دیگه.اگه قرار باشه با چنین بحث و جدل های شیرین علمی(که البته طرفین توش نفع می برن و از هم یاد می گیرن!) بهم بریزم ک کلاهم پس معرکه ست...
من از اولش می خواستم ی موضوعی رو بیان کنم: حالا حتی اگه فرض کنیم پیوندهای قطبی داره اوریک اسید(ک داره!) دلیلی نمیشه ک کل مولکول قطبی باشه( قطبیت زیاد فعلا پیشکشش!)چیزای دیگه ای دخیل هست برای قطبیت مولکول ها....
من دوتا مثال می زنم:
ویتامین A یا رتینول با ساختار زیر
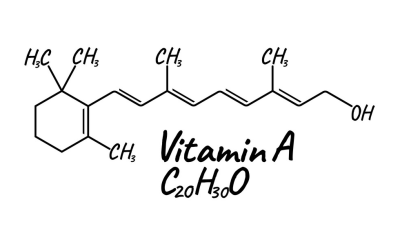
یک گروه عاملی الکلی اون ته داره که میتونه با آب تبادل الکترون کنه و با یون های حاصل پیوند یونی بزنه ولی توجه کنید این ساختار وزن مولکولی و حجم خیلی گنده ای نسبت به مولکول آب داره و تشکیل یه پیوند یونی آن هم از یک طرف دلیل انحلال پذیری کم آن در آب است!
ویتامین C یا آسکوربیک اسید
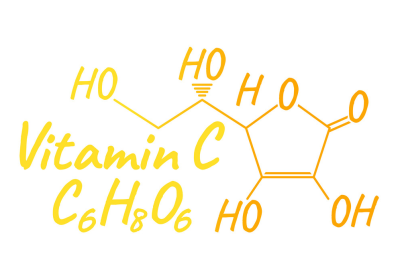
گروه های متعدد عاملی دارد که پس با تعداد زیادی مولکول آب می تواند تبادل یون کند و جاذبه ی قوی بین این گروه های عاملی با یونهای تولیدی در آب به وجود میاد و میشه گفت این جاذبه ها از طرفین ساختار برقرار میشن که حلالیت بالا ی آن را در آب توجیه می کند...
تو مثال اسید اوریک مثلا اون اتم N ها که الان یه جفت نا پیوندی دارن ب نظرت میتونن به صورت داتیو یک یون H+ از آب بگیرن و یون آمونیوم تشکیل بدن؟؟(تو اوره چی؟؟)
در ضمن ما حتی اگه نتونیم هم توجیهش کنیم انحلال پذیری پایین اوریک اسید تو آب رو....نمیایم که ردش کنیم این موضوع رو!! گرفتی؟؟ ما که نمی تونیم به آزمایش و اون چیزی ک از تجربه بدست میاد بگیم تو چون با نظر ذهنی ما نمی خونی پس تو غلطی...اون چیزی ک تو ذهن ما بوده صد درصد غلط بوده!( واکنش های انحلال توی آب اینا معمولا ب صورت تعادلیه ولی تو مثال ویتامین A ثابت تعادل خیلی کوچیکه یعنی غلظت فراورده ها خیلی ناچیزه ولی تو واکنش انحلال ویتامین C ثابت تعادل بزرگه یعنی غلظت فراورده ها ک فرم یونی هستن زیاده!!)
:rose: -
Saudade 19 0 معذرت واسه چی؟؟
من بهم ریختنامو گذاشتم برای جاهای دیگه.اگه قرار باشه با چنین بحث و جدل های شیرین علمی(که البته طرفین توش نفع می برن و از هم یاد می گیرن!) بهم بریزم ک کلاهم پس معرکه ست...
من از اولش می خواستم ی موضوعی رو بیان کنم: حالا حتی اگه فرض کنیم پیوندهای قطبی داره اوریک اسید(ک داره!) دلیلی نمیشه ک کل مولکول قطبی باشه( قطبیت زیاد فعلا پیشکشش!)چیزای دیگه ای دخیل هست برای قطبیت مولکول ها....
من دوتا مثال می زنم:
ویتامین A یا رتینول با ساختار زیر

یک گروه عاملی الکلی اون ته داره که میتونه با آب تبادل الکترون کنه و با یون های حاصل پیوند یونی بزنه ولی توجه کنید این ساختار وزن مولکولی و حجم خیلی گنده ای نسبت به مولکول آب داره و تشکیل یه پیوند یونی آن هم از یک طرف دلیل انحلال پذیری کم آن در آب است!
ویتامین C یا آسکوربیک اسید

گروه های متعدد عاملی دارد که پس با تعداد زیادی مولکول آب می تواند تبادل یون کند و جاذبه ی قوی بین این گروه های عاملی با یونهای تولیدی در آب به وجود میاد و میشه گفت این جاذبه ها از طرفین ساختار برقرار میشن که حلالیت بالا ی آن را در آب توجیه می کند...
تو مثال اسید اوریک مثلا اون اتم N ها که الان یه جفت نا پیوندی دارن ب نظرت میتونن به صورت داتیو یک یون H+ از آب بگیرن و یون آمونیوم تشکیل بدن؟؟(تو اوره چی؟؟)
در ضمن ما حتی اگه نتونیم هم توجیهش کنیم انحلال پذیری پایین اوریک اسید تو آب رو....نمیایم که ردش کنیم این موضوع رو!! گرفتی؟؟ ما که نمی تونیم به آزمایش و اون چیزی ک از تجربه بدست میاد بگیم تو چون با نظر ذهنی ما نمی خونی پس تو غلطی...اون چیزی ک تو ذهن ما بوده صد درصد غلط بوده!( واکنش های انحلال توی آب اینا معمولا ب صورت تعادلیه ولی تو مثال ویتامین A ثابت تعادل خیلی کوچیکه یعنی غلظت فراورده ها خیلی ناچیزه ولی تو واکنش انحلال ویتامین C ثابت تعادل بزرگه یعنی غلظت فراورده ها ک فرم یونی هستن زیاده!!)
:rose:MohsenTaheri
ممنون بابت وقتی ک میذاری
راستش یه جوری بود کامنت قبلیت که حس کردم میخوای بگیری از پشت مانیتور بزنی ام :|
ببین همه حرفات و قبول دارم خب....
ولی همه حرف من اینه
اوریک اسید سه تا گروه عاملی کربونیل داره(شدیدا قطبی)...4 تا هم NH که هم خودشون قطبی ان(حالا زیادم نه ولی خب دیگ) و هم باعث میشن آب بتونه باهاشون پیوند هیدروژنی برقرار کنه
و اینکه کلا 2 تا پیوند ناقطبی هست تو این مولکول
الان دقیقا کدوم عامل باعث میشه همه ی اینا برن کنار و اوریک اسید انحلالش کم بشه تو آب؟ -
MohsenTaheri
ممنون بابت وقتی ک میذاری
راستش یه جوری بود کامنت قبلیت که حس کردم میخوای بگیری از پشت مانیتور بزنی ام :|
ببین همه حرفات و قبول دارم خب....
ولی همه حرف من اینه
اوریک اسید سه تا گروه عاملی کربونیل داره(شدیدا قطبی)...4 تا هم NH که هم خودشون قطبی ان(حالا زیادم نه ولی خب دیگ) و هم باعث میشن آب بتونه باهاشون پیوند هیدروژنی برقرار کنه
و اینکه کلا 2 تا پیوند ناقطبی هست تو این مولکول
الان دقیقا کدوم عامل باعث میشه همه ی اینا برن کنار و اوریک اسید انحلالش کم بشه تو آب؟Saudade 19 0 خواهش می کنم.
اینایی ک گفتید سرجای خودشون...پیوند قطبی که داره می تونه هیدروژنی هم بزنه ولی مولکولش از کجا قطبی شد؟؟؟ مولکول آلی دارای بخش قطبی و ناقطبی است که بخش ناقطبی(شامل حلقه های آلی و زنجیره های هیدرو کربنی ک این دومی رو نداره!) و قسمتای قطبی گروهای عاملی که بخش ناقطبی غلبه داره....
گروه های عاملی نیتروژنا میتونن داتیو H+ بگیرن و بشن N+ ک اینا بیان جاذبه بدن با یونای هیدروکسید تو ی آب و بخوان حلالیت ایجاد کنن ولی مشکل اینه این یونای تولیدی کمن و ساختار خیلی تمایل داره به فرم مولکولی باقی بمونه!








