رسانایی الکتریکی
-
سلام اینجا یه سوالی برام پیش اومد اینکه میدونیم هر چه قدر غلظت اسید ضعیف بیشتر باشه درجه یونش اون اسید کمتره. از بین استیک اسید و هیدروفلوریک اسید در این سوال هر دو اسیدضعیفن ولی خب قدرت اسیدی HFبیشتره از استیک اسید. پاسخنامه میگه گزینه 4.چرا 3 نمیتونه باشه؟
نمیدونم شاید سوالم خیلی ساده باشه یا درست نباشه.
ممنون میشم جواب بدید. 🙏🏻

-
 P Pluto marked this topic as a question on
P Pluto marked this topic as a question on
-
-
دوست عزیز بیاین مول یونها در هرکدوم رو بدست بیارین هرکی مول بیشتری داد رسانایش بیشتر دقت حجم محلول برای همه یکسان هست تو این سوال
-
دوست عزیز بیاین مول یونها در هرکدوم رو بدست بیارین هرکی مول بیشتری داد رسانایش بیشتر دقت حجم محلول برای همه یکسان هست تو این سوال
@Rahman-Atafat پس الان چیزی که من گفتم ینی اشتباهه کلا؟
اگه اشتباهه میشه بگید چرا یکم گیج شدم🤦🏻♀️ -
@Rahman-Atafat پس الان چیزی که من گفتم ینی اشتباهه کلا؟
اگه اشتباهه میشه بگید چرا یکم گیج شدم🤦🏻♀️ -
@Rahman-Atafat بله
-
@Rahman-Atafat ممنون نیاز نیست بفرستید!
-
 P Pluto has marked this topic as solved on
P Pluto has marked this topic as solved on
-
 P Pluto marked this topic as a regular topic on
P Pluto marked this topic as a regular topic on
-
و همین جور برای اون دوتای دیگه هم بنویسین اما نکته اینه که اینا اسید ضعیف هستن و کامل یونیده نمیشن ولی چون HF اسیدی تر از بقیه هست پس بین 4دهم مول یونهای استیک و 4دهم مول یونهای HF HF برنده هست چون میزان یونشش بیشتر از اون استیک هستش دقتتتتتتتتتتتتتتتتتتتت اینا اسید ضعیف هست تو اگر در گزینه یک 1 دهم مول استیک بریزی تو آب همش وارد واکنش نمیشه ولی من برا راحتی کار فرض کردم کلا یونش میابند و مول یونها رو با استو بدست آوردم و درنهایتت در گزینه 2 که عکسشو فرستادم مول یونهام شد 4 دهم در گزینه 4 هم که حساب کنی بازم مول یونها 4 دهم میشه حالا بین گزینه دو و 4 کی برندس خب اینجا HF برنده هست چون ثابت اسیدی اون بیشتر از استیک هستش برا همین قبلا هم گفتم اون مقدار یونها که مدست اوردم فرضی هست واگرنه عمرا یک دهم و یا دو دهم استیک و یا HF بریزی ان قدر یون بهت بدن ولی چون ثابت تعادل HF بیشتر هست پس میزان یونشش از استیک بیشتر پس مول یونهاشم بیشتر هست یعنی یک 3/4 دهم یکی 2/5 ( اعداد فرضی ) هستش
-
و همین جور برای اون دوتای دیگه هم بنویسین اما نکته اینه که اینا اسید ضعیف هستن و کامل یونیده نمیشن ولی چون HF اسیدی تر از بقیه هست پس بین 4دهم مول یونهای استیک و 4دهم مول یونهای HF HF برنده هست چون میزان یونشش بیشتر از اون استیک هستش دقتتتتتتتتتتتتتتتتتتتت اینا اسید ضعیف هست تو اگر در گزینه یک 1 دهم مول استیک بریزی تو آب همش وارد واکنش نمیشه ولی من برا راحتی کار فرض کردم کلا یونش میابند و مول یونها رو با استو بدست آوردم و درنهایتت در گزینه 2 که عکسشو فرستادم مول یونهام شد 4 دهم در گزینه 4 هم که حساب کنی بازم مول یونها 4 دهم میشه حالا بین گزینه دو و 4 کی برندس خب اینجا HF برنده هست چون ثابت اسیدی اون بیشتر از استیک هستش برا همین قبلا هم گفتم اون مقدار یونها که مدست اوردم فرضی هست واگرنه عمرا یک دهم و یا دو دهم استیک و یا HF بریزی ان قدر یون بهت بدن ولی چون ثابت تعادل HF بیشتر هست پس میزان یونشش از استیک بیشتر پس مول یونهاشم بیشتر هست یعنی یک 3/4 دهم یکی 2/5 ( اعداد فرضی ) هستش
-
@Rahman-Atafat ممنون



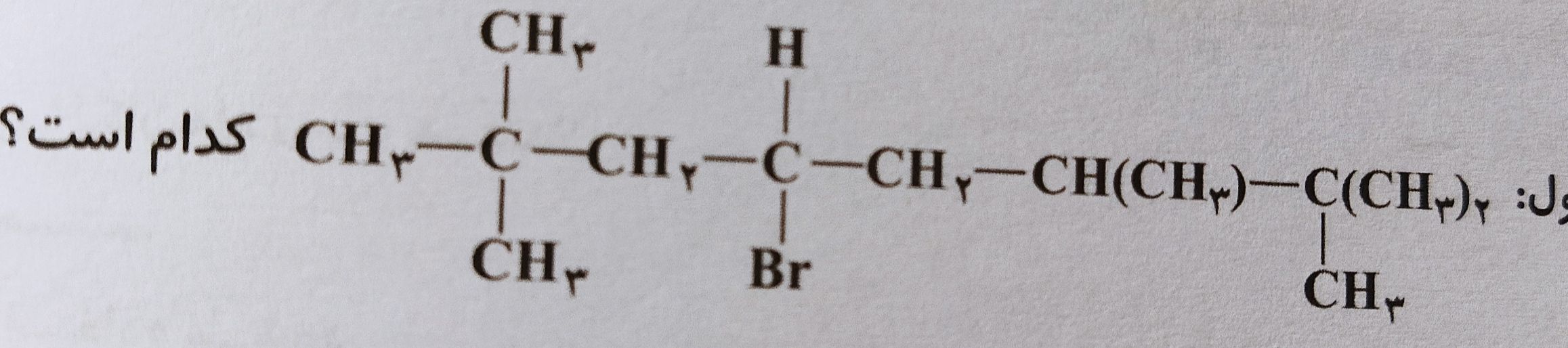

 این از گزینه اول
این از گزینه اول این گزینه 2
این گزینه 2