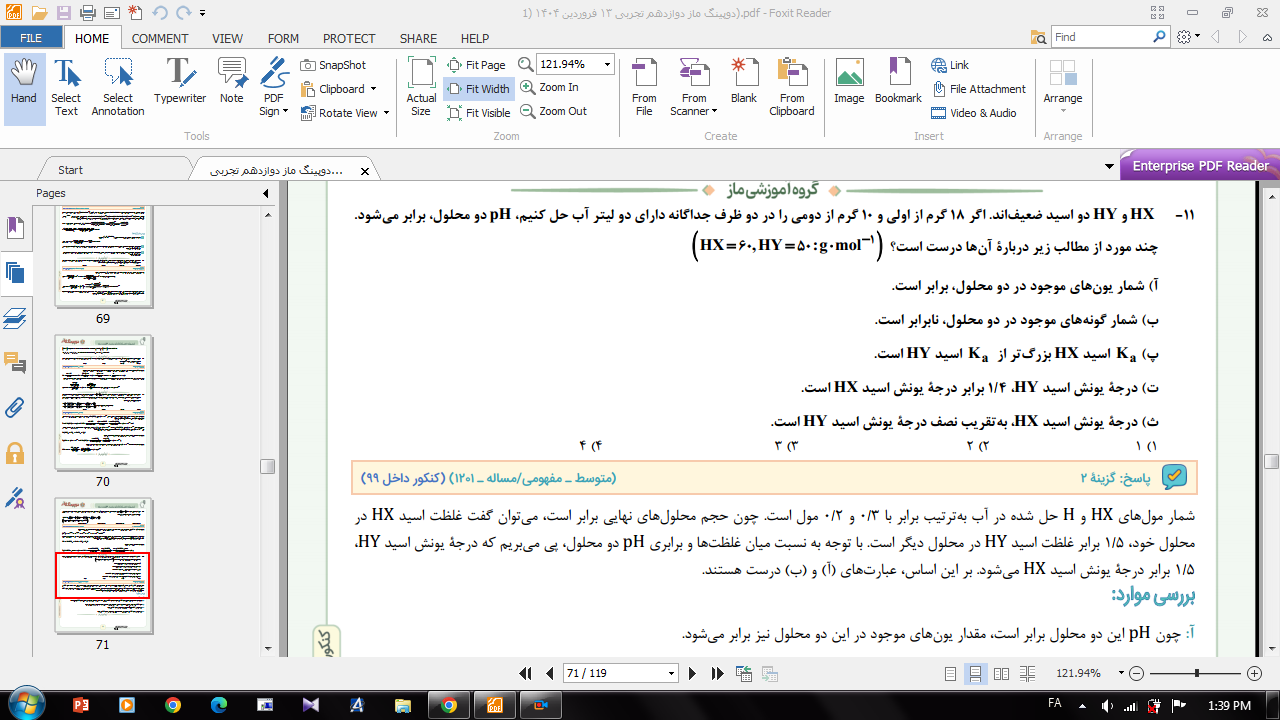
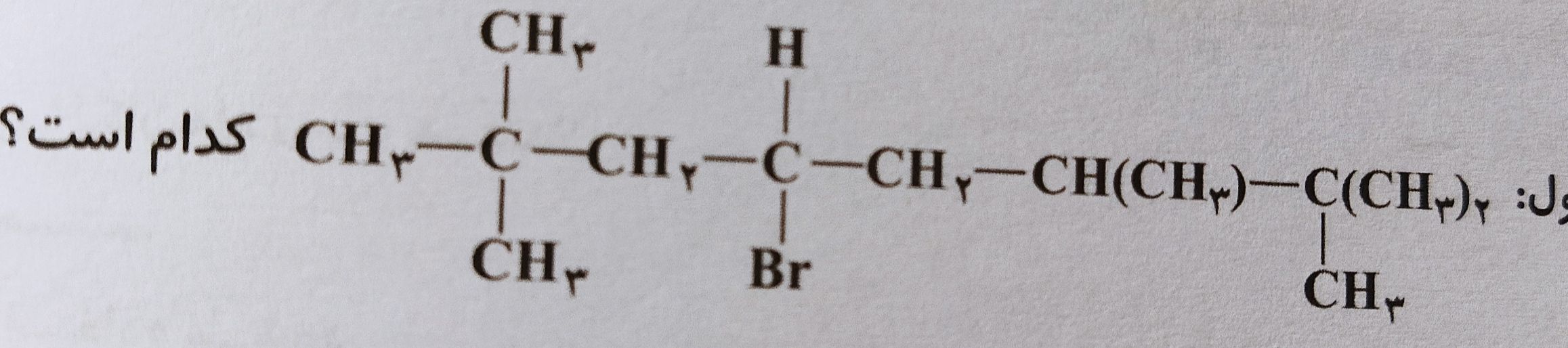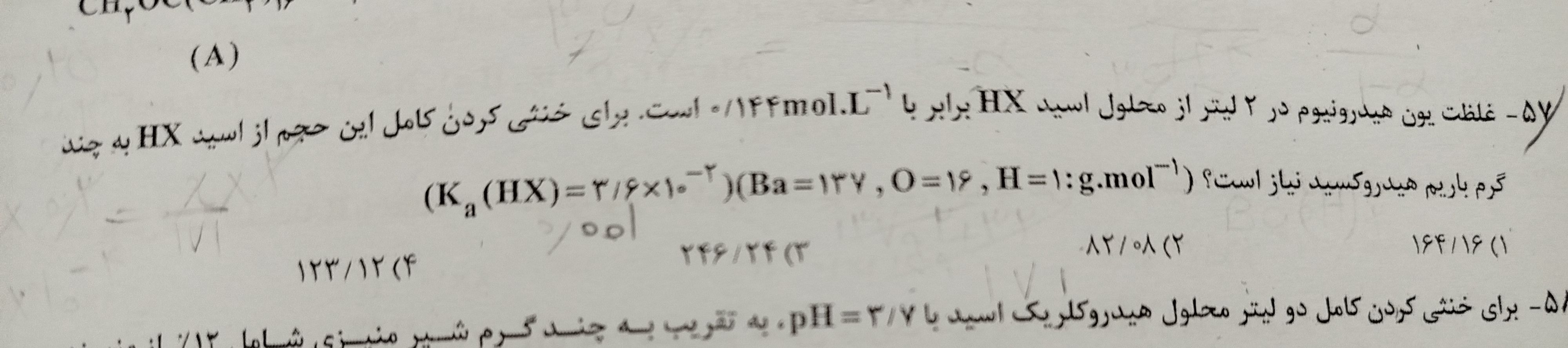سوال از خنثی شدن اسید باز
-
VictorKeke در سوال از خنثی شدن اسید باز گفته است:
@romisa1234
خب ایول تا اینجاش رو میدونم،خیلی عالی اشاره کردین،
ولی راه حلی که برای سوال دوم جواب داده، چطور بدون در نظر گرفتن درجه تفکیک آمونیاک، جواب میده؟ ما از روی درصد تفکیک، غلظت اسید رو حساب میکنیم، درست. ولی بعد غلظت در حجم ضرب میکنیم و حجم باز میاد این قسمتش کامل مفهوم نیست.
این قسمتش کامل مفهوم نیست.ما مول اون دو تا رو مقایسه می کنیم غلظت در حجم.
اگه مول یکی رو داشته باشیم و غلظت اون یکی دیگه رو ، حجم اون یکی دیگه بدست میاد@romisa1234
خب آره، ولی هنوز حس میکنم کامل مفهوم نیست مطلب
-
@mahdis127
من خیلی خیلی از وقت شما متشکرم، ولی میشه صرفا بیخیال بشید و بگید بلد نیستید سوالم رو؟ بخدا تاج سرید شما، من ارادتمند شما هستم، ولی نه تنها سوال اصلی من رو جواب ندادید بلکه دو روزه سر یک مسئله ساده دارید بحث میکنید.VictorKeke اکی شرمنده که من نمیفهمم
-
@romisa1234
خب آره، ولی هنوز حس میکنم کامل مفهوم نیست مطلب
VictorKeke در سوال از خنثی شدن اسید باز گفته است:
@romisa1234
خب آره، ولی هنوز حس میکنم کامل مفهوم نیست مطلب
مبتکران شیمی دارین ؟
-
VictorKeke در سوال از خنثی شدن اسید باز گفته است:
@romisa1234
خب آره، ولی هنوز حس میکنم کامل مفهوم نیست مطلب
مبتکران شیمی دارین ؟
@romisa1234
نه خیلی سبز دارم -
VictorKeke اکی شرمنده که من نمیفهمم
@mahdis127 بخاطر ندونستن نیازی به عذرخواهی نیست، بزرگوارید شما
-
VictorKeke در سوال از خنثی شدن اسید باز گفته است:
@romisa1234
خب ایول تا اینجاش رو میدونم،خیلی عالی اشاره کردین،
ولی راه حلی که برای سوال دوم جواب داده، چطور بدون در نظر گرفتن درجه تفکیک آمونیاک، جواب میده؟چون ما از روی مولار آمونیاک ، مولش رو به دست میاریم و نیازی به داشتن درجه تفکیکش نیست.
غلظت در حجم در ظرفیت که میشه مولش.مولار اسید رو از راه غلظت یون هیدرونیوم به دست میاریم بعد در حجم و ظرفیت اسید ضرب می کنیم مولش به دست میاد بعد با مول آمونیاک مقایسه می کنیم
@romisa1234
آهان، خیلی عالی،
یه سوال دیگه،
الان با توجه به این توضیحات،
سوال 1=
یک لیتر محلول یک مولار استیک اسید، با یک لیتر محلول یک مولار آمونیاک خنثی میشه؟
سوال2=
یک لیتر محلول یک مولار اسید، با یک لیتر محلول یک مولار باز خنثی میشه؟
سوال3=
یک لیتر محلول یک مولار اسید قوی با یک لیتر محلول یک مولار باز ضعیف خنثی میشه؟
سوال اصلی (که از همون اول داره مغزم رو میخوره)===
وقتی ما صرفا غلظت مولار اسید و باز رو در نظر میگیریم، درجه تفکیک """ چرا""" مهم نیست؟ -
@romisa1234
آهان، خیلی عالی،
یه سوال دیگه،
الان با توجه به این توضیحات،
سوال 1=
یک لیتر محلول یک مولار استیک اسید، با یک لیتر محلول یک مولار آمونیاک خنثی میشه؟
سوال2=
یک لیتر محلول یک مولار اسید، با یک لیتر محلول یک مولار باز خنثی میشه؟
سوال3=
یک لیتر محلول یک مولار اسید قوی با یک لیتر محلول یک مولار باز ضعیف خنثی میشه؟
سوال اصلی (که از همون اول داره مغزم رو میخوره)===
وقتی ما صرفا غلظت مولار اسید و باز رو در نظر میگیریم، درجه تفکیک """ چرا""" مهم نیست؟VictorKeke
1)بلعه
2)خیر بستگی ب ظرفیت ها هم داره
3)تعریف جدید و امروزی اسید و باز رو مدنظر بگیرید،نه تعریف ارنیوس رو...پس درجه یونش مهم نیست،اون مقداری هم ک یونش پیدا نکرده و بصورت مولکولی حل شده میتونه وارد واکنش خنثی شدن شه(شما اصلا فرض کنید ما اسید خالص(نه محلول)رو با باز جامدی واکنش دادیم(این فقط ی مثال برای فهم سوال بود نه حل سوالا با اون)) -
VictorKeke
1)بلعه
2)خیر بستگی ب ظرفیت ها هم داره
3)تعریف جدید و امروزی اسید و باز رو مدنظر بگیرید،نه تعریف ارنیوس رو...پس درجه یونش مهم نیست،اون مقداری هم ک یونش پیدا نکرده و بصورت مولکولی حل شده میتونه وارد واکنش خنثی شدن شه(شما اصلا فرض کنید ما اسید خالص(نه محلول)رو با باز جامدی واکنش دادیم(این فقط ی مثال برای فهم سوال بود نه حل سوالا با اون))tamom
خیلی ممنونم از جوابتون.
نکته ای که از دید من پنهان بود این بود که در تفکیک جزئی، وقتی خنثی شدن در کار هست، به مرور که از هاش مثبت ها مصرف میشه، باز تعادل به سمت راست حرکت میکنه و بیشتر تفکیک میشه. تا جایی که اگر محدود کننده نباشه کل مواد مصرف میشن و ما در مخاسبات میتونیم اینها رو اسید و یا باز قوی در نظر بگیریم