سلام سلاااام🤩
بچه ها تو این تاپیک میخوایم دانشجوها هم مثل کنکوریا ساعت مطالعه شون رو اعلام کنن ✌
هم انگیزه بشه برای فارغ التحصیلای آلاء تا تو محیط دانشگاه هم دست از تلاشِ آلائی برندارن 💪و هم اینکه کنکوریای با درسایی که دانشجوها میخونن یکم آشنا میشن🤗
پس از امشب استارت این تاپیک رو میزنیم و هرشب میایم و میگیم در طول روز چ درسایی رو خوندیم ،چند ساعت و چیکارا کردیم😁
دعوت میکنم از @فارغ-التحصیلان-آلاء که باهامون همراه بشن🤝
خیلی ممنون از z Gheibi و M.ba78 بابت پیشنهاد و همراهیشون❤
راستی از romisa جانم هم دعوت میکنم بهمون سر بزنه و همراهیمون کنه😍
سلام به بچه های عزیز آلا🌻
خب دوستان تو این تاپیک قراره که تجربه هامون رو از دانشجویی بگیم
نحوه درس خوندن، نحوه ارتباطات،خوابگاه و... هر صحبتی که تو ذهن تون هست
که ورودی های امسال مون بتونن استفاده کنن😊
ممکنه حتی یه سری نکات و صحبت ها بگیم که خودمون هم ندونیم و بهمون کمک بشه😅
و اینکه بچه های جدید حتما سوالات شون رو بپرسن
@فارغ-التحصیلان-آلاء @رتبه-های-انجمن-آلاء
@تجربیا @ریاضیا @انسانیا
@بچه-های-تجربی-کنکور-1402
@بچه-های-ریاضی-کنکور-1402
@همیار
سلام.
تا حالا فک کردین به یه سیستم عامل دیگه مهاجرت کنین؟ گاهی اوقات حس نکردین از ویندوز خسته شدین؟
خب من درمانش رو دارم بیاین لینوکس بریزیم، همه!
اصلا لینوکس چیه؟
خب اینه: "لینوکس (Linux) یک سیستم عامل رایگان و متن باز است که بر پایه هسته Linux (کرنل) توسعه داده شده است. هسته لینوکس مسئولیت مدیریت منابع سختافزاری و ارتباط بین نرمافزار و سختافزار در سیستم را بر عهده دارد."
متن بازی (open source ) یعنی چی؟ یعنی کد هاش برای همه آزاد و همه می تونن بیاین لینوکس رو تغییر بدن، (گویی انگولش کنن) اما ویندوز این شکل نیست کدهای توسعه ویندوز، رو فقط خود مایکروسافت داره. (واسه همین ویندوز گرونه 199 دلار ویندوز 11 پرو 😲 )
خلاصه اش اقا اینکه لینوکس یه هسته ی اصلی داره حالا می رسیم به توزیع های لینوکس.
اینم تاریخچه ش :در سال 1991 فردی با نام لینوس توروالدز (Linus Torvalds)، دانشجوی رشته علوم کامپیوتر در دانشگاه هلسینکی فنلاند، تصمیم گرفت یک سیستم عامل جدید بر اساس یونیکس (Unix) طراحی کند. او نیازمند یک سیستم عامل برای استفاده شخصی و توسعه برنامههای خود بود. لینوس کد منبع سیستم عامل خود را در اینترنت منتشر کرد و خواستار کمک و بازخورد از جامعه برنامهنویسی شد. این کد با عنوان “هسته لینوکس” شناخته میشد.
گروهی از برنامهنویسان از سراسر جهان به لینوس پیوستند و شروع به توسعه و بهبود هسته لینوکس کردند. این جامعه برنامهنویسی فعال با همکاری بینالمللی سایر برنامه نویسان باعث شد هسته لینوکس به سرعت رشد کند. در سال 1994، نسخه اولیه رسمی Linux با ورژن 1.0 منتشر شد. این نسخه اولیه شامل امکانات اساسی سیستم عامل شبیه به یونیکس بود و از آن پس، توسعه و بهبودهای بیشتری در هسته لینوکس صورت گرفت.
(اینجاش مهمه)
با گذر زمان، جامعه برنامهنویسی Linux رشد کرد و شرکتها و سازمانها نیز به توسعه و پیشرفت لینوکس کمک کردند. این شرکتها شامل ردهت (RedHat)، اینتل (Intel)، آیبیام (IBM) و بسیاری دیگر بودند. به مرور و با گذشت زمان، Linux به عنوان یک سیستم عامل پرکاربرد، به ویژه در سرورها و دستگاههای همراه، شناخته شد. همچنین، توزیعهای لینوکس محبوبی مانند اوبونتو (Ubuntu)، فدورا (Fedora) و دبیان (Debian) با امکانات و رابط کاربری متنوعی ارائه شدند.
از آن زمان تا به امروز، Linux به یکی از قدرتمندترین و پرطرفدارترین سیستم عاملها تبدیل شده است و در بسیاری از زمینهها از توزیع های مختلف Linux استفاده میشود، از جمله سرورها، دستگاههای هوشمند و رایانههای شخصی.
اگه به میخواین در آینده مهندسی نرم افزار، کامپیوتر، ای تی، شبکه و هزاران چیز دیگه مربوط به علوم کامپیوتر و کامپیوتر بخونین پیشنهاد می کنم همین الان لینوکس رو نصب کنید.
حالا چه توزیعی بریزیم؟
من نزدیک 1.5 ساله از ویندوز مهاجرت کردم به لینوکس و تاحالا سه تا توزیع مختلف روی ماشین مجازی ریختم و تست کردم. عملا انچنان تفاوت خاصی با هم ندارند ولی
برای شروع پیشنهاد می کنم (یعنی خیلی نوبی) : اوبونتو (ubuntu) یا linux mint یا manjaro ، این توزیع های خوبن
من در حال حاضر از manjaro استفاده می کنم که واقعا توزیع مناسبیه، ولی اگه اصلا لینوکس کار نکردین ubuntu یا linux mint بریزین.
حالا چجوری لینوکس بریزیم؟
مثلا برای نصب ubuntu میرم تو گل سرچ می کنیم download ubuntu و وبسایت رسمی ubuntu نسخه اخرین نسخه LTS اوبنتو رو بریزین ( در حال حاضر اخرین نسخه Ubuntu 24.04.1 LTS) هستش
[LTS یعنی چه مخفف long-term support یعنی ما معنی پنج سال به روز رسانی رایگان امنیتی میدیم که یعنی توزیع پایدار و با ثباتی واسه همین برای تازه کارا مناسبه]
یه فایلی به پسوند iso. دانلود میشه.
با نرم افزار refus این فایل رو روی یه فلش یا سی دی بوت می کنیم ( آموزش هاش داخل آقای گوگل هست و می تونین سی دی اوبونتو رو بخرید که بوت شده)
فلش رو وصل می کنیم، سیستم یه ریستارت می زنیم بعد قبل اینکه سیستم بالا بیاد یکی از دکه های f12 یا f10 یا del یا ... ( با توجه به نوع مادربرد، لپتاپ و ... احتمال 99 درصد f12 هستش) از منو بوت فلش رو انتخاب می کنیم و تامام وارد پنجره نصب اوبونتو میشیم که به شدت ساده هستش، داخل اینترنت میلیون ها آموزش نصب اوبنتو و بقیه توزیع ها هستش)
▶️| #معرفی_رشته
بریم برای یه معرفی رشته ی جداب
#مهندسی_پزشکی
☁️رشته ی مهندسی پزشکی چیه؟
ساخت تجهیزات پزشکی یکی از کارهایی هست که بچه های این رشته انجام میدن
این علم تلاش می کنه تا مهندسین پزشکی بتونن از ایده های پزشکی استفاده کنن
🌥کسی که این رشته رو خونده باید چه ویژگی هایی داشته باشه؟
خلاقیت و نو اوری داشته باشه
مسلط به زبان انگلیسی باشه
نرم افزار های تخصصی طراحی رو بلد باشه
قادر به تحلیل نیاز های مشتریان و بیماران باشه
ریاضی، فیزیک، زیست و شیمی اش قوی باشه
⛅️ تهش چی میشه؟
کار در شرکت های تخصصی تجهیزات پزشکی
کار در شرکت های دانش بنیان در حوزه ی مهندسی پزشکی
نمایندگی فروش و خدمات پس از فروش تجهیزات پزشکی وارداتی
طراحی و ساخت دستگاه های تشخیص مشکلات پزشکی و بیماری ها
کار و تحقیق در جنبه های فنی و مهندسی مربوط به سیستم های بیولوژیکی انسان ها و حیوانات
نصب، تنظیم و نگهداری، تعمیر یا پشتیبانی فنی تجهیزات پزشکی با عنوان متخصص تجهیزات پزشکی بیمارستانی
🌤 مسیر تحصیلی اش چیه؟
کارشناسی: مهندسی پزشکی
کارشناسی ارشد: بیوالکتریک، بیومکانیک، بیومتریال
دکتری: مهندسی بافت، رباتیک پزشکی، پردازش سیگنال ها با تصاویر پزشکی، ابزار دقیق پزشکی، مهندسی ورزش، بیوالکتریک، بیومکانیک، بیومتریال
منبع یک کاناله امیدوارم اطلاعات درست باشند. باز هم خودتون بررسی کنید
@ida-shateri
@بچه-های-کنکور-ریاضی-1400
@ریاضیا
سلام
امیدوارم حالتون خوب باشه
یلدای گذشته مبارکتون 🙂❄️🌸
یه سوال داشتم از دانشجو های آلایی
روش خاصی برای جزوه نویسی دارین ؟
اون دسته دروسی که علاوه بر فایل ، صحبتای استاد هم مهمن رو چیکار میکنین ؟
من خودم نکات اضافه ی گفته شده سر کلاس و فایل خود استاد ( در صورتی که استاد فایلشو بده 🙄 ) رو با هم تو جزوه پاک نویس میکنم ولی خب آخر ترم با حجم بالای نکات چرکنویس و فایلای نوشته نشده روبرو میشم😐💔
و از طرفی خوندن و تسلط روی مطالب نسبت به جزوه نویسی مهم تره ، مخصوصا الان که نزدیک به امتحانات ترم هستیم
ممنون میشم تجربیاتتون در این زمینه رو به اشتراک بذارین 🙏🌸
شاید یکی از نقاط عطف زندگیتون در دوران دانشجویی،فارغ از اینک چی میخونید یادگیری زبان برنامه نویسی اندروید،با توانایی ساخت اپلکیشن،میتونید هم به درآمدی برسید هم مشکلات زیادی رو که پیش میاد واستون رفع کنید...پیشنهاد من این از بیسیک فور اندروید شروع کنید(b4a),ساده ،روان ،قوی
کل چیزی که نیاز دارید؛
۱)ی سیستم ساده کامپوتری
۲)ی گوشی
۳) سه ماه وقت گذاشتن و تمرین
هر سوالی هم در این زمینه داشتید میتونید اینجا بپرسید،از مراحل نصب و ساخت تا انتشار در مارکت ها..
سلول های بنیادی راهی به آینده
-
محققین در مطالعه ای جدید بر بازبرنامه ریزی سلولی متکی بوده اند تا مدل از نظر ژنتیکی مشابهی از سلول های پیر و جوان ارائه دهند. آن نها سلول های بنیادی مزانشیمی را از مایع سینوویال جداسازی کرده و آن ها را به سلول های بنیادی پرتوان القایی(iPSCs) بازبرنامه ریزی کردند.
در ادامه آن ها این سلول های iPS را مجددا به به سلول های بنیادی مزانشیمی القا کردند تا به نوعی موجب جوان سازی سلول های بنیادی مزانشیمی اولیه شوند. در ادامه این سلول های بنیادی مزانشیمی بازبرنامه ریزی و جوان شده با سلول های بنیادی مزانشیمی اولیه مقایسه شدند. آنالیزها نشان داد که بیان GATA6 به عنوان یک پروتئین مهم در تکوین سیستم گوارشی، قلب و ریه در سلول های بازبرنامه ریزی شده سرکوب شده بود.
این سرکوب GATA6 منجر به افزایش فعالیت پروتئین های ضروری برای تکوین جنینی موسوم به SHH و هم چنین افزایش بیان FOXP1 شد که برای تکوین مناسب قلب، ریه و مغز ضروری است. این مطالعه نشان می دهد که مسیر GATA6/SHH/FOXP1 یک مسیر کلیدی است که پیری و جوان سازی سلول های بنیادی مزانشیمی را تنظیم می کند و این یافته ها می تواند درک ما را در مورد پیری سلول های بنیادی مزانشیمی که فاکتوری تاثیرگذار در پزشکی بازساختی است افزایش دهد.
Reference:https://medicalxpress.com/news/2020-11-gene-responsible-cellular-aging.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

فناوری چاپگرهای سهبعدی که با زیستمواد میتوانند بافتهای مبتنی بر سلولهای زنده را تولید کنند، توسط یک شرکت فناور داخلی بومی سازی شده است.
مجموعه فناور ایده کاران سهبعدی شریف با نقش آفرینی فعالان حوزههای مهندسی مکانیک، الکترونیک، نرمافزار، زیستمواد، سلولی و مولکولی بر روی ساخت چاپگرهای سهبعدی زیستی فعالیت میکند و زمینه را برای تولید چاپگرهای زیستی آغاز کرده است.
در این مجموعه فناور برای نخستین بار چاپگر سهبعدی زیستی بر پایه نیوماتیک با قابلیت چاپ سلولهای زنده در محیط تمیز طراحی و توسعه داده شد که به کمک آن میتوان بافتهای مصنوعی را با دقت و سرعت بالا تولید کرد.
هم اکنون نمونههای تجاری این دستگاه در حال فعالیت در مراکز پژوهشی و ارائه خدمت به استادان و دانشجویان حوزه مهندسی بافت و پزشکی بازساختی است. با ارائه این محصول به محققان و فعالان فناور، زمینه تولید فرآوردههای پرکاربرد در حوزه زیستی و سلامت فراهم میشود.
برخورداری از قابلیتهای نمونه خارجی
مدلهای مختلف این دستگاه با استفاده از قطعهها و قابلیتهای مختلف، از قابلیت چاپ انواع هیدروژل حاوی سلول، بایومتریالهای کامپوزیت حاوی پلیمرهای زیستتخریبپذیر و ترکیبی از هردو عنصر را دارد. با بهرهگیری از این دستگاه بافتهای مصنوعی مورد نظر خود را با اهداف گوناگون ایجاد کرده و مورد تست و بررسی قرار دهند.
این دستگاه با قابلیت کنترل دما از صفر تا 175 درجه سانتیگراد این امکان را میدهد که طیف وسیعی از مواد را به چاپ برساند. قابلیتهای لینک کردن با استفاده از نور فرابنفش این چاپگر با استفاده از دو منبع نور، قدرت بالا را در محدوده طول موج 365 و 405 نانومتر ارائه میکند. دستگاه به گونهای ساخته شده که جابهجایی آن آسان است و میتوان آن را به مکانهای خاص انتقال داد.
فعالان فناور این شرکت، قابلیت و جابهجایی بستر دستگاه را به گونهای طراحی کردهاند که بتواند با دقت 5 میکرون در هر جهت حرکت کند. چاپگر زیستی با قابلیت چاپ پلیمرها و هیدروژلها در محیطی بدون آلودگی و ذرات معلق، میتواند راه را برای چاپ سلول هموار کند.
این شرکت با حمایت ستاد توسعه علوم و فناوریهای سلولهای بنیادی معاونت علمی و فناوری محصول خود را توسعه داده است.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
به نظر می رسد که مهار آنزیمی به نام کیناز زیپر لوسین دو گانه (DLK) قویا از نورون ها در برابر طیف وسیعی از بیماری های مخرب عصبی حمایت می کند اما این آنزیم بازسازی آکسون ها را نیز مهار می کند. تاکنون روش موثری برای تعدیل ژن ها به منظور بهبود بقای طولانی مدت نورون ها و هم چنین پیشبرد بازسازی آکسون ها ارائه نشده است.
در مطالعه ای جدید، تیمی از محققین در دانشگاه کالیفرنیا خانواده ای از آنزیم ها موسوم به کیناز های GCK-IV را شناسایی کرده اند که مهار آن ها قویا از نورون ها حفاظت می کند و این در حالی است که اجازه بازسازی آکسون ها را نیز می دهد و همین امر آن را به یک رویکرد درمانی جذاب برای درمان برخی از بیماری های مخرب عصبی تبدیل می کند.
در این مطالعه محققین ابتدا سلول های گانگلیونی شبکیه(RGCs) را از سلول های بنیادی تولید کردند و در ادامه مجموعه ای از غربالگری ها را روی آن ها انجام دادند. این سلول های گانگلیونی شبکیه، نوعی نورون هستند که در نزدیک سطح داخلی شبکیه چشم قرار گرفته اند. آن ها اطلاعات بینایی را از گیرنده های نوری دریافت می کنند و با تجمیع آن ها به انتقال شان به مغز کمک می کنند. نتیجه غربالگری مواد شیمیایی مختلف، شناسایی مهار کننده خانواده آنزیمی GCK-IVبود که هم از سلول های گانگلیونی شبکیه حفاظت می کند و هم اجازه بازسازی آکسون ها را می دهد.
https://www.pnas.org/content/117/52/33597
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
محققان در مطالعه ای جدید سعی داشته اند که شبکه های ژنی و پروتئینی که در بیماری های قلبی مادرزادی دچار مشکل می شوند را شناسایی کرده اند. شماری از جهش های ژنتیکی در این بیماری های قلبی مادرزادی دخیل هستند که اولین مورد آن ها که شناسایی شد مربوط به ژنی به نام Tbx5 بود. پروتئین TBX5، فاکتور رونویسی است که بیان چندین ژن مختلف را در پایین دست خود کنترل می کند. بیشتر مطالعاتی که روی اثر جهش های Tbx5 بر قلب صورت گرفته است بر مطالعات جانوری(موشی) متمرکز بوده است.
در پژوهشی جدید، دکتر برانیو و همکارانش این اثر را در سلول های انسانی مورد مطالعه قرار دادند. آن ها از سلول های بنیادی پرتوان القایی(iPSCs) استفاده کردند و با استفاده از فناوری ویرایش ژنومی CRISPR/Cas9 جهش Tbx5 را در این سلول ها ایجاد کرده و سپس آن ها را برای تبدیل شدن به سلول های قلبی القا کردند. در حین تمایز قلبی این سلول ها، محققین آن ها را مورد توالی یابی RNA در سطح تک سلولی قرار دادند تا ژن هایی که تحت تاثیر جهش Tbx5 قرار می گیرند را شناسایی کنند.
ارزیابی ها نشان داد که ژن های بی شماری تحت تاثیر Tbx5 جهش یافته در سطوح بالاتر یا پایین تر بیان می شوند، هر چند همه سلول ها پاسخ یکسانی به جهش Tbx5 ندارند. این تنوع در جهش و پاسخ دهی به جهش را محققین دلیل نشان دادن علایم مختلف بوسیله بیماران می دانند.
https://medicalxpress.com/news/2020-12-reveals-networks-genes-involved-congenital.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
در جدید ترین مطالعه صورت گرفته در دانشگاه سانگکیونکوان، پروژه ای به منظور بررسی اثر اگزوزوم مشتق شده از سلول بنیادی مزانشیمی بر روی کنترل خون ریزی مغزی آغاز گردید. این مطالعه با اشاره به اثر مثبت فراورده سلولی بر روی مهار خونریزی مغز،نتایج خود را در مجله STEM CELLS Translational Medicine. به چاپ رسانید.
به دنبال خونریزی شدید در مغز و افزایش فشار مایعات در این ناحیه، احتمال تشنج، فلج مغزی، عقب ماندگی رشد و مرگ و میر افزایش می یابد. لذا اهمیت این جستار میتواند روزنه امیدی را برای درمان به موقع بیماران، خصوصا کودکان (از بالاترین جامعه آماری در این نوع عارضه محسوب میشود) به حساب آید.
سلولهای بنیادی مزانشیمی قادر هستند تا با تولید مولکولهای زیستی فعال، اثر بسیار خوبی در ترمیم از خود نشان دهند.
این سلولها اگرچه امروزه به عنوان کاندیدهای مناسب در علوم پزشکی بازساختی به حساب میآید، اما عوارضی همچون قابلیت تومورزایی و انسداد عروق را میتواند به دنبال داشته باشد.
در این پژوهش با استفاده از اگزوزومهای دریافت شده از محیط کشت سلولهای بنیادی مزانشیمی، اثر آن را بر روی مدل موشی، دارای خونریزی مغزی مورد پژوهش قرار گرفته شد. نتایج نشان داد که اگزوزومهای منتقل شده حاوی فاکتور mRNA کد کننده پروتئین BDNFهستند. تحقیقات پیشین نقش این پروتئین را به عنوان یک عامل محافظتی برای سلولهای عصبی گزارش کرده است. این مطالعه در دو فاز آزمایشگاهی و پیش بالینی انجام گرفت و در تمامی گروهای دریافت کننده، اگزوزومها باعث بیان گیرندههای ترومبین در سطح سلولهای عصبی شد.
از این رو Park اظهار داشت که: " تاثیر استفاده از اگزوزومها برای مهار خونریزی بیشتر از استفاده از سلولهای بنیادی به صورت مستقیم میباشد. همچنین با توجه به مطالعات بعدی برای مشخص نمودن زمان مناسب تزریق و دوز بهینه، اظهار امیدواری از یک گام موثر برای مقابله با آثار ناشی از افزایش فشار مایعات مغزی در زمان خونریزی نمود.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
طی تکوین مغز، دوره جنینی در تولید نورون ها از سلول های بنیادی عصبی و تبدیل آن ها به به مغز بالغ دارای عملکرد حیاتی است. هر گونه اختلالی در برنامه تکوینی می تواند منجر به نواقص شدید مغزی شود. سندرم X شکننده یک اختلال ژنتیکی است که بوسیله ناتوانی ذهنی و علایم اوتیسم مشخص می شود.
کودکان مبتلا به سندرم X شکننده عموما از تاخیر در فرایندهای تکوینی و مشکلات اجتماعی و رفتاری رنج می برند. سندرم X شکننده دچار نقص در ژن FMR1 هستند که ژن کد کننده پروتئین FNRP به عنوان یک فاکتور کلیدی در تکوین طبیعی مغز است. در این مطالعه دکتر اوسامی و همکارانش با استفاده از توالی یابی های نسل جدید صدها مولکول مرتبط با مغز جنین موشی را شناسایی کرده اند که نه تنها با فرایند نورون زایی بلکه ناتوانی های اوتیسمی و ذهنی همراه هستند.
یافته های این مطالعه نشان داده است که گروهی از مولکول های خاص در مسیرهای پیام رسانی بین سلولی مانند Ras/MAPK، Wnt/β-catenin و mTOR دخیل هستند. فعالیت mTOR در مغز جنینی موش های ناقص از نظر FMR1 بارز است و به نظر می رسد که فعالیت افزایش یافته mTOR می تواند منجر به تکثیر غیر طبیعی و تمایز سلول های بنیادی به مغز جنینی شود. در نهایت، این مکانیسم های مولکولی می توانند مسئول تکوین مغز طی دوره جنینی و مشارکت آن ها در بروز سندرم X شکننده باشند. محققین امیدوارند این اطلاعات جدید بتواند راهگشای درمان اختلالت تکوینی عصبی در آینده باشند.
https://molecularbrain.biomedcentral.com/articles/10.1186/s13041-020-00706-1
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
نسل جدید سلول هایCAR-T ، نتایج مثبتی را در فاز II آزمایش علیه مولتوم میلوما ثبت کرده است. این مطالعه که به سرپرستی دانشمندان انستیتو سرطان Dana-Farber (MA ، ایالات متحده آمریکا) صورت گرفته بود، منجر به بهبودی تقریباً 75٪ از بیماران با عود مجدد شده است. بطوریکه این روش به طور قابل توجهی حاکی از تاثیر بهتر نسبت به روش های درمانی موجود است. نتایج این پژوهش اخیراً در مجله New England Journal of Medicine به چاپ رسیده است.نویسنده این پژوهش اذعان داشت: "علیرغم پیشرفتهای متعدد در درمان مولتیپل میلوما، عود مجدد در این بیماران شایع است. بیمارانی که پس از دریافت درمان استاندارد همچنان رو به وخامت می روند ، گزینه های درمانی نسبتاً کمی برای پاسخ دهی مناسب پیش رو دارند. نتایج این آزمایش نشان دهندهی یک نقطه عطف واقعی در درمان این بیماری است چراکه در 30 سالی که میلوما را درمان کردم ، هیچ درمان دیگری را در این گروه از بیماران تا این حد موثر ندیده ام. "
درمان های فعلی برای میلوما شامل سه دسته اصلی است: داروهای تعدیل کننده سیستم ایمنی ، مهار کننده های پروتئازوم و آنتی بادی های ضد CD38. با این حال ، بیمارانی که در برابر این روشها مقاوم هستند ، نیاز فوری به جایگزینهای درمانی بهتر دارند.
مانند سایر روشهای درمانی مبتنی بر CAR-T ، این روش نوین شامل از بین بردن سلولهای T خود بیمار و اصلاح آنها برای هدف قرار دادن سلولهای سرطانی بیمار است. در مورد این روش، سلولهای T اصلاح می شوند تا پروتئین روی سلولهای میلوما که مسئول رشد و بقای آنها است را مورد هدف قرار دهند.
این تیم با توجه به نتایج مثبتی که در آزمایش آنها مشاهده کردند، درخواستی را به FDA آمریكا ارائه داده و در آن درخواست تصویب استفاده از این نوع سلول های CAR-T برای معالجه بیماران مبتلا به عود مجدد میلوما و یا مقاوم به درمان طرح کرده اند .
Link:https://www.regmednet.com/novel-car-t-therapy-sees-success-in-treatment-resistant-myeloma-patients/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

سلولهای بنیادی چگونه در درمان سرطان ایفای نقش میکند(1)سلولها علیه سلولها؛ شاید به بیان ساده بتوان نقش سلولهای بنیادی در درمان سرطان را اینگونه تعریف کرد. بیماری سرطان از تکثیر بیش از اندازه سلولها پدید میآید و چه خوشخیم باشد و چه بدخیم، بیمار را رنج میدهد؛ اما با پیشرفت فناوری و به کمک سلولهای دیگری که سلولهای بنیادی نامیده میشوند، نبردی تازه علیه سرطان شکل گرفته است.
پیوندی برای احیای سلامتی
پیوند سلولهای بنیادی مغز استخوان یک روش درمانی پزشکی است که سلولهای سالم را در مغز استخوان بیمار جایگزین می کند. سلولهای جایگزین می توانند از بدن فرد یا از یک اهداکننده دریافت شده باشند.
به پیوند مغز استخوان، پیوند سلول های بنیادی یا به طور خاص تر، پیوند سلولهای بنیادی خون ساز گفته می شود. از پیوند میتوان برای درمان انواع خاصی از سرطان مانند سرطان خون ، میلوما، سرطان غدد لنفاوی (لنفوم) و سایر بیماری های خون و سیستم ایمنی بدن که مغز استخوان را تحت تأثیر قرار می دهند ، استفاده کرد.
یکی از پیشرفت های بزرگ در زمینه پیوند سلول های بنیادی کشف سلول های بنیادی خون ساز بود که قادرند تمام رده های سلول های خونی را تولید کنند. تعریفی از سلول های بنیادی و مغز استخوان بتواند تصویر روشنتری از کارکرد آنها را ارائه دهد.
سلولهای بنیادی، می توانند به سلولهای مختلف مورد نیاز بدن تبدیل شوند. انواع مختلفی از سلول های بنیادی وجود دارد و در زمان های مختلف در نقاط مختلف بدن یافت می شوند. سلول های بنیادی خونساز ، سلول های بنیادی هستند که به سلول های خونی تبدیل می شوند.
مغز استخوان، یک بافت نرم و اسفنجی در بدن است که سلول های بنیادی خونساز را در خود دارد. این ماده در مرکز بیشتر استخوانها یافت می شود. سلولهای بنیادی خونساز نیز در خون موجود در سراسر بدن یافت می شود.
وقتی سلول های بنیادی خونساز آسیب ببینند، ممکن است به سلول های قرمز خون، گلبول های سفید و پلاکت تبدیل نشوند. این سلولهای خونی بسیار مهم هستند و هر یک وظیفه متفاوتی دارند.
پیوند سلولهای بنیادی مغز استخوان، یک روش پزشکی است که در آن سلول های بنیادی سالم به مغز استخوان یا خون پیوند میخورد. این روش، بدن را برای ایجاد گلبول های قرمز، گلبول های سفید و پلاکت های مورد نیاز توانمند می کند.
@دانش-آموزان-آلاء
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

سلولهای بنیادی چگونه در درمان سرطان ایفای نقش میکند(2)روشهای گوناگون
پیوند مغز استخوان یا سلول های بنیادی انواع مختلفی دارد که پیوند اتولوگ یکی از آنها به شمار میرود. در این روش، سلولهای بنیادی برای پیوند اتولوگ از بدن خود بیمار گرفته میشود. گاهی اوقات روشهای مرسوم مقابله با سرطان مانند شیمی درمانی یا پرتودرمانی کارآمد نیست و استفاده از آنها، می تواند به سلول های بنیادی و سیستم ایمنی بدن بیمار آسیب برساند. به همین دلیل است که پزشکان قبل از شروع درمان سرطان، سلولهای بنیادی را از خون یا مغز استخوان خارج میکنند.
پس از شیمی درمانی، سلول های بنیادی به بدن شما بازگردانده می شوند و سیستم ایمنی بدن و توانایی بدن شما در تولید سلول های خونی و مبارزه با عفونت را بازیابی میکنند.
اما پیوند آلوژنیک نوع دیگری از پیوند سلولهای بنیادی است. سلول های بنیادی برای پیوند آلوژنیک از شخص دیگری به نام اهدا کننده دریافت می شود. سلولهای بنیادی اهدا کننده پس از شیمی درمانی یا پرتودرمانی به بیمار داده می شود. پیدا کردن اهداکننده منطبق با ویژگیهای بیمار، یک مرحله ضروری برای انجام این نوع پیوند است.
بانک اطلاعاتی جامع برای پیوند سلولهای بنیادی سالم به بیمار
همخوان بودن ویژگیهای یک اهدا کننده سالم و پروتئین های خون او ، آنتی ژن های لکوسیت انسانی (HLA) نامیده می شوند ، حائز اهمیت بالایی است. به این فرآیند،Typing HLA گفته می شود.
در حال حاضر با حمایت معاونت علمی و فناوری ریاست جمهوری، فناوری HLA Typing در داخ کشور و با تلاش یک شرکت دانشبنیان بومی سازی شده است.
این فناوری ضمن قطع وابستگی کشور به واردات سلول های بنیادی خون ساز، با شکل گرفتن شبکه ملی اهداکنندگان سلول های بنیادی خون ساز، امکان صادرات این سلول ها را به کشورهای دیگر فراهم می کند.
با امکان ارائه خدمت HLA Typing به سایر کشورهای منطقه و صرفه جویی ارزی، این فناوری از خروج میلیون ها دلار ارز از کشور که برای واردات سلولهای بنیادی از خارج کشور و انجام HLA Typing در خارج کشور جلوگیری می کند. با حذف واردات سلولهای بنیادی از خارج کشور، از بروز تأخیر چندماهه در فرایند درمان بیمار جلوگیری میشود.
همچنین از سلولهای بنیادی خون بند ناف استفاده می شود. بند ناف قبل از تولد جنین را به مادر متصل می کند. پس از تولد ، کودک نیازی به آن ندارد. مراکز درمانی سرطان در سراسر جهان از جمله کشورمان از سلولهای بنیادی خون بند ناف برای درمان بسیاری از بیماریها استفاده می کنند.
با پیشرفت فناوریهای حوزه سلولهای بنیادی، شرکتهای دانشبنیان و فناور کشورمان نیز در مسیر توسعه این فناوری و حرکت به سوی درمان سرطانها گام برداشتند. این شرکتها که در حوزههای گوناگون فناوری پیوند سلولهای بنیادی همچون تجهیزات و ادوات پیوند، ارائه خدمات بانک خون بند ناف به روش فرا دقیق- فراسریع فعالیت میکنند توانستهاند بخش قابل توجهی از نیازهای فناورانه کشور در این حوزه را تامین کنند.
با حمایت ستاد توسعه علوم و فناوری سلولهای بنیادی معاونت علمی و فناوری ریاست جمهوری از شرکتهای دانشبنیان این حوزه برای توسعه فناوری پیوند سلولهای بنیادی و نجات بیماران، ضمن مسدود شدن راه خروج ارز از کشور به واسطه هزینههای هنگفت درمان خارج از کشور یا تجهیزات این حوزه، زمینه برای معرفی ایران به عنوان یکی از کشورهای پیشرو و موفق در حوزه پژوهشها و فناوریهای سلولهای بنیادی فراهم شده است.
@دانش-آموزان-آلاء
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
محققان موسسه تحقیقات مرکز پزشکی کودکان در UT Southwester (CRI; TX, USA ایالات متحده آمریکا) سلول های مسئول نگهداری و بازسازی کبد و محل قرارگیری آنها در کبد را شناسایی کرده اند. این مطالعه که در Scienceمنتشرشده است ، به برخی سوالات اساسی در مورد بازسازی کبد ، آسیب و سرطان کبد پاسخ می دهد.
با وجود آنکه قرنها است که قدرت بازسازی کبد شناخته شده است، اما مطالعات قبلی در این زمینه به دلیل کمبود نشانگرهای زیستی مانع از تشخیص عملکرد انواع مختلف سلولهای کبدی شده بود. با این حال ، محققان آزمایشگاهCRI’s Zhuتوانستند با مقایسه ژنهایی که مارکرهای سلولهای کبدی را در سراسر کبد مشخص می کنند، این چالش را برطرف کنند و آنهایی را که فقط توسط زیرمجموعه های خاص سلولهای کبدی روشن می شوند شناسایی کنند. سپس از این ژنها به عنوان یک نشانه برای تشخیص هویت و عملکرد زیر مجموعههای مختلف سلولهای کبدی استفاده شد.
به دنبال این پروژه که منجر به ایجاد 11سویه جدید مدل موشی شد، هرکدام دارای یک نشانگر برای گروه خاصی از سلولهای کبدی بودند. این مدلسازی آنها را قادر می سازد تا تشخیص دهند کدام یک از این سلولها مسئول بازسازی کبد پس از آسیب هستند، و مستقیما نقش هر مجموعه سلولی را در نگهداری و بازسازی کبد مقایسه کنند.
محققان در این مطالعه توانستند ارتباطی را بین محل تجمع هر دسته سلول و نوع فعالیت آن شناسایی کنند. سلولهای موجود در ناحیه لب 2باعث ایجاد سلولهای کبدی نواحی 1و 3در کبد می شود این در حالی است که سلولهای ناحیه 1و 3نشان دادند که نقش بسزایی در بازسازی کبد ناشی از آسیب های کبدی ایفا میکند. بعلاوه ، با قرار دادن موشها در معرض مواد شیمیایی که از اشکال متداول آسیب کبدی را در این جانداران مدل میکند، نشان دادند که سلولهای منطقه 2در بهسازی و یازسازی کبد به صورت غیر مستقیم نقش ایفا میکند.
"در انسان ، سلولهای مناطق 1و 3اغلب توسط الکل ، استامینوفن و ویروس های آلوده کننده کبد آسیب می بینند. بنابراین منطقی است که سلولهای منطقه ، 2که در معرض آسیبهای سمی هستند، با تقویت دو ناحیه 1و 3در بازسازی این آسیب ها نقش ایفا میکند. " "با این حال ، تحقیقات بیشتری برای درک انواع مختلف سلول در کبد انسان لازم است."
مطالعه بیشتر در مورد ژنهای مهم برای رشد و بازسازی در این عضو منجر به کشف محور -IGFBP2-mTOR CCND1شد ، مسیری که در منطقه 2نسبت به مناطق 1و 3فعال تر بود. اختلال در این مسیر، برای موش ها به معنی آن بود که سلول های ناحیه 2دیگر قادر به تولید سلولهای کبدی جدید نبودند، بنابراین این مسیر را به عنوان مکانیسم احیا کننده استفاده شده توسط سلولهای منطقه 2معرفی کردند.
Zhuاظهار داشت: "شناسایی سلولهای کبدی منطقه 2به عنوان یک جمعیت احیا کننده به برخی سوالات اساسی در مورد فعالیت های کبدی پاسخ می دهد و می تواند نقش مهمی را در بیماری کبد داشته باشد. علاوه بر این، از ابزار و راهکاری که ما برای شناسایی انواع مختلف سلولهای کبدی ایجاد کرده ایم، می توان برای بررسی چگونگی واکنش سلولهای مختلف به هنگام آسیب کبدی یا تغییرات ژنتیکی که باعث سرطان کبد می شوند، استفاده کرد. "
Link: https://www.regmednet.com/cells-responsible-for-liver-regeneration-identified/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

انجمن جراحی پلاستیک آمریکا اعلام کرده است که استفاده از PRPطی چهار سال گذشته 25 درصد رشد داشته است. این افزایش توجه به این عامل را می توان به تبلیغاتی نیز ربط داد که بوسیله افراد مشهور برای نشان دادن مزایای درمانی و زیبایی این محصول ارائه شده است.
به عقیده محققین نیز استفاده از PRP می تواند منجر به فعال شدن فرایندهای طبیعی ترمیمی بدن فرد شود و بدین ترتیب شکل و عملکرد بافت را بهبود ببخشد. PRP دارای مشخصه هایی است که آن را به یک منبع جذاب برای استفاده در جراحی پلاستیک تبدیل کرده است: به راحتی و به ارزانی بوسیله سلول های خود بیمار تولید می شود و با خطر و عوارض جانبی اندکی همراه است.
با این حال، استفاده از این فاکتور بویژه در مورد رویکردهای زیبایی، زمان بر است و نیازمند فرایندهای چند مرحله ای است. پلاکت به عنوان نوی سلول خونی دخیل در فرایند لخته شدن، در زمان بروز یک آسیب به ناحیه زخم آمده و مانع از خونریزی بیشتر می شود. نشان داده شده است که پلاکت ها بیش از 30 فاکتور و پروتئین از نظر زیستی فعال را ترشح می کنند که در تشکیل عروق خونی جدید و رشد بافت دخیل هستند. در سال های اخیر مشخص شده است که استفاده از PRP رو به افزایش است و تنها در آمریکا در سال 2019، بیش از 130 هزار مورد استفاده از PRP برای جراحی های پلاستیک و زیبایی گزارش شده است. از جمله زمینه های کلیدی که از PRP به عنوان یک مکمل استفاده می کنند می توان به جراحی های جوان سازی پوست، رشد مجدد مو، درمان با لیزر و گرافت های چربی اشاره کرد.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
پژوهشگران چینی در آکادمی علوم پکن یک غربالگری مبتنی بر CRISPR/Cas9 گسترده را با استفاده از دو نوع سلول پیش ساز مزانشیمی انسانی که پیری تسریع شده را نشان می دهند، انجام دادند. این سلول های پیش ساز مزانشیمی از سلول های بنیادی جنینی انسانی مشتق شدند که حامل جهش های بیماری زایی بودند که منجر به بیماری پیری تسریع شده سندرم ورنر و سندرک پروجریای هاچینسون-گلیفورد می شوند.
با استفاده از این مدل ها، محققین ژن هایی را شناسایی کردند که نقصان آن ها منجر به پیری سلولی می شود و در هر دو مدل پیری سلولی ذکر شده وجود داشتند که از جمله آن ها می توان به KAT7 اشاره کرد که یک هیستون استیل ترانسفراز است. غیر فعال سازی KAT7 موجب کاهش استیلاسیون هیستون H3 شد و این امر نیز موجب سرکوب رونویسی شد و پیری سلول های پیش ساز مزانشیمی را کاهش داد. به عقیده محققین استفاده از غربالگری ژنتیکی مبتنی بر CRISPR/Cas9، یک روش قوی برای کشف ژن های دخیل در پیری مانند KAT7 است و می توان آن ها را هدف درمانی مناسبی برای ایجاد مداخلات درمانی برای پیری دانست.
https://stm.sciencemag.org/content/13/575/eabd2655
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

به گزارش روابط عمومی و امور بین الملل ستاد توسعه علوم و فناوری های سلول های بنیادی، شرکت ژرف اندیشان فناور زیست بسپار از شرکت های مورد حمایت ستاد، موفق به ساخت ماده MTT، یکی از پرمصرف ترین مواد شیمیایی مورد استفاده در آزمون سمیت سلولی برای تعیین میزان سمیت سلولهای مختلف در آزمایشگاههای زیستی و سلولی شده است.
ماده تیازولیل بلو تترازولیوم بلو یا همان MTT، یک پودر زرد رنگ برپایه نمک تترازولیوم است که در تماس با سلولهای جانداران، وارد اندامک میتوکندری شده و پس از واکنش با آنزیمهای میتوکندریایی به کریستالهای نامحلول در آب با رنگ بنفش تبدیل میشود. غلظت این ماده بنفش رنگ میتواند نشانگر تعداد سلولها باشد. در آزمایشگاههای تشخیص طبی، از این ماده میتوان برای تعیین تعداد سلولهای یک بافت مشخص مثلا بافت سرطانی و تاثیر یک داروی مشخص برای از بین بردن آن سلولها استفاده کرد. همچنین، در آزمایشگاههای مورد تایید سازمان غذا و دارو، و اداره تجهیزات پزشکی از این ماده برای تعیین میزان سمیت یا سلول سازگاری یک دارو یا تجهیز پزشکی استفاده میشود.
این ماده که تا پیش از این به عنوان یک ماده مهم همواره به صورت وارداتی در اختیار مراکز پزشکی، بیمارستانی، دانشگاهی و پژوهشگاهی قرار میگرفت، اکنون به صورت کامل در شرکت دانش بنیان ژرفاندیشان فناور زیست بسپار بومیسازی شده است و برای نخستین بار به عنوان یک محصول ایرانی در دسترس پژوهشگران و اساتید محترم قرار میگیرد. این محصول که از نظر کیفیت با محصول شرکتهای مطرح آمریکایی رقابت میکند، با قیمتی بسیار مناسب و پایینتر از محصول خارجی (25-30 درصد قیمت محصول خارجی) به فروش میرسد. دشواری و پیچیدگی ساخت این ماده در طی چندین مرحله واکنش شیمیایی موجب افزایش قیمت به همراه ارزش افزوده بالاتر شده است. علاوه بر این با توجه به اهمیت استفاده از این ماده در زمینههای مختلف برای سنجش سمیت سلولی و وسعت کاربرد این محصول را به یک ماده استراتژیک تبدیل کرده است.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
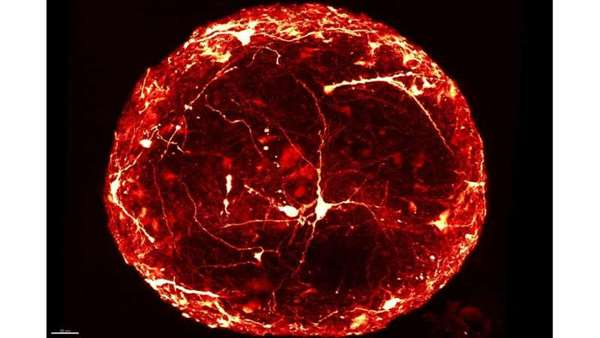
مینی مغزهای شخصی می توانند با استفاده از سلول های بنیادی گرفته شده از نمونه های پوست و موی فرد تولید شوند و اطلاعاتی را در مورد پیشرفت بیماری های مغزی در یک فرد و همم چنین پاسخ دهی آن فرد به داروها ارائه کنند. برخلاف پیشرفت های زیاد صورت گرفته در رشد و تولید مینی مغزها، درک جزئیات دقیق آن چه در درون این مینی مغزها اتفاق می افتد بسیار مشکل است و معمولا محققین برای درک این امر نیازمند برش گیری و مشاهده آن ها زیر میکروسکوپ هستند و همین امر می تواند به نمونه آسیب بزند.
برای اولین بار در مطالعه ای جدید محققین در مرکز تحقیقات HEPIA تصاویر سه بعدی با رزولوشن بالا از تک تک نورون های درون مینی مغزهای دست نخورده ارائه کرده اند. به این منظور آن ها تکنیک های جدید نشان دار کردن نورون های منفرد را با روش هایی که کل نمونه را کاملا شفاف می سازند، ترکیب کرده اند. این محققین یک ماژول سفارشی و بسیار پیشرفته و مجهز به تشخیص دهنده های تصویری بسیار حساس را برای گرفتن تصاویر سه بعدی از مینی مغزهای کاملا سالم تولید کرده اند و در نتیجه نیازی به برش گیری از این مینی مغزها نیست. به موجب این تصاویر می توان مورفولوژی سه بعدی نورون های خاص و پراکنش آناتومیک آن ها درون مینی مغزها را مشاهده کرده و آنالیز کرد.
https://www.frontiersin.org/articles/10.3389/fbioe.2020.582650/full
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
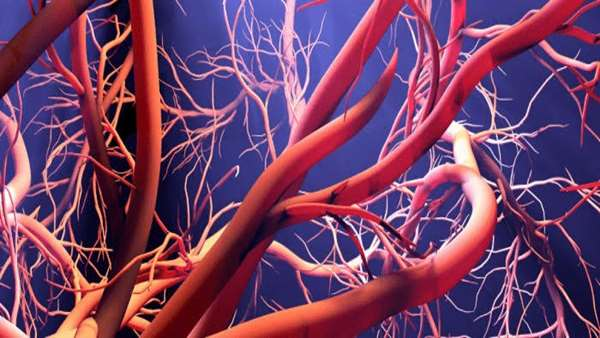
دانشمندان از دانشگاه پزشکی فوجیتا (Aichi ، ژاپن) یک پروتئین با فعالیت رگ زایی را که توسط باکتریهای جنس بارتونلا آزاد می شود ، کشف کرده اند از این رو آنها این فاکتور آنژیوژنیک (BafA) را بارتونلا A نامیده اند. این اولین گزارش از پروتئین شبه فاکتور رشد اندوتلیال عروقی (VEGF) است که توسط باکتری تولید میشود.نتایج این مطالعات در مجله Nature Communications. به چاپ رسیده است.
محققان با وارد کردن Bartonella henselae (B. henselae) به سلولهای اندوتلیال انسان در شرایط آزمایشگاهی، مشاهده کردند که این باکتریها باعث تکثیر سلولهای اندوتلیال میشوند. آنها سپس جهش های تصادفی را در DNA باکتریها ایجاد کردند تا ژنهایی را که در فرایند رگ زایی نقش ایفا میکنند، شناسایی شوند. این باعث شد که آنها کشف کنند که B. henselae تنها در صورت داشتن نسخه سالم از BafA می تواند رگ زایی را در سلولهای اندوتلیال را تحریک کند.
این تیم سپس نمونههای آئورت را از موشها استخراج کرده و درون محیط های کشت دارای BafA و فاقد آن قرار داد. در نمونههایی که آئورت در معرض BafA قرار گرفته بودند رگهای خونی جدید رشد کردند ، در حالی که نمونه های آئورت که در معرض BafA قرار نگرفتند رگ های خونی جدید رشد نکردند.
به دنبال آزمایشات بیشتر in vitro با سلولهای اندوتلیال انسانی نشان داده شد که BafA گیرنده های سطح سلول را که VEGF را تشخیص می دهند فعال می کند. وقتی BafA به این گیرنده ها متصل شود، باعث فعال شدن پروتئین های MAPK و ERK می شود بطوریکه این مسیرها نقش مهمی در رگ زایی دارند.
یوهی دوئی توضیح داد: "ما معتقدیم كه پروتئین های BafA میتوانند به عنوان ابزاری برای مطالعه رگ زایی استفاده شوند و همچنین مزایای بالقوه پزشكی را نیز در نظر میگیریم."
Link: https://www.regmednet.com/novel-bafa-protein-shown-to-stimulate-angiogenesis/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
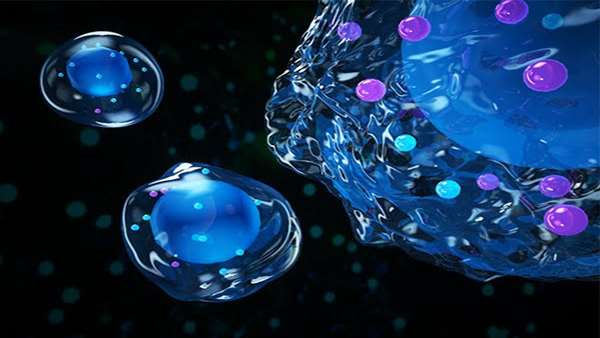
در حال حاضر محدودیت های زیادی برای استفاده از سلول های بنیادی با اهداف مختلف از درمان سرطان های خونی گرفته تا اختلالات خونی ارثی وجود دارد که نیازمند پیوند مغز استخوان هستند. سلول های بنیادی خون ساز مسئول خودنوزایی دائمی خون و تولید میلیاردها سلول جدید به صورت روزانه هستند. این سلول های بنیادی خون ساز پتانسیل نامحدودی برای خودنوزایی خودشان در تمام طول عمر فرد دارند و در تمام این مدت انواع مختلف سلول های خون از جمله سلول های ایمنی را تولید می کنند.
با این حال تعداد این سلول ها در مغز استخوان بسیار محدود است و از هر 2500 سلول، یک مورد از آن ها سلول بنیادی خون ساز است. یک راه برای تولید بیشتر سلول های بنیادی خون ساز، یافتن راهی برای افزایش تعداد آن ها در مغز استخوان، جریان خون و خون بند ناف و راه دیگر بازبرنامه ریزی سایر سلول های بنیادی خونی برای تولید سلول های شبه سلول های بنیادی خون ساز است. در این مسیر، محققین از الگوریتمی به نام VIPER برای شناسایی پروتئین هایی که بتوانند سایر سلول های بنیادی خونی را بازبرنامه ریزی کنند استفاده کردند و پروتئینی به نام BAZ2B را شناسایی کردند که قادر است تعداد سلول های بنیادی خون ساز را در خون و خون بند ناف به طور قابل توجهی افزایش دهد.
این پروتئین از طریق بازآرایی مجدد کروماتین عمل می کند و موجب باز شدن مناطق خاصی از ژنوم می شود که پیش از این در دسترس نبودند. پیوند این سلول های بنیادی جدید به مغز استخوان موش هایی که از نظر ایمنی سرکوب شده بودند، کاملا موفقیت آمیز بود. به عقیده محققین پروتئین BAZ2B می تواند مشکل کمبود سلول های بنیادی خون ساز در شرایط درون تنی و هم چنین تکثیر محدود آن ها در شرایط برون تنی را حل کرده و راهگشای استفاده بهتر از آن ها در بالین باشد.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

انستیتوی ملی بهداشت و مراقبت انگلستان (NICE) پیش نویس رهنمودهای استفاده از onasemnogene abeparvovec (Zolgensma
 ) برای درمان آتروفی عضلانی نخاع (SMA) در NHS انگلیس منتشر کرد. کنسرسیوم داروهای اسکاتلند (گلاسگو ، اسکاتلند) نیز استفاده از ژن درمانی را که توسط ژن درمانی Novartis (AveXis سابق) ساخته شده است ، تأیید کرده است.
) برای درمان آتروفی عضلانی نخاع (SMA) در NHS انگلیس منتشر کرد. کنسرسیوم داروهای اسکاتلند (گلاسگو ، اسکاتلند) نیز استفاده از ژن درمانی را که توسط ژن درمانی Novartis (AveXis سابق) ساخته شده است ، تأیید کرده است.Meindert Boysen (مرکز ارزیابی فناوری سلامت در NICE) توضیح داد: "SMA یک وضعیت بسیار جدی ، ناتوان کننده و ناراحت کننده است که تأثیرات بسزایی در همه جنبه های زندگی مبتلایان به SMA و خانواده و مراقبان آنها دارد."
دارویی که در حال حاضر توسط NICE برای درمان SMA و SMA نوع 1 ، 2 و 3 قبل از علائم توصیه می شود ، داروی ضد حساسیت الیگونوکلئوتید nusinersen است که باید به طور منظم مصرف شود.
زولگنسما به صورت یک تزریق داخل وریدی تجویز می شود و برای استفاده در نوزادان تا 12 ماهگی با نوع 1 SMA تأیید شده است. در پیش نویس راهنمای NICE همچنین استفاده از زولگنسما در نوزادان دارای SMA پیش از علامت توصیه می شود. برای کودکان 7 تا 12 ماهه ، به دلیل محدود بودن اطلاعات بالینی موجود برای این گروه سنی ، لازم است که یک تیم بالینی چند در مورد نوع درمان آن پژوهش و بررسی کنند.
بویزن نویسنده این پژوهش اذعان داشت: "Zolgensma نشان دهنده یک پیشرفت مهم در درمان SMA است که نه تنها می تواند به کودکان اجازه دهد نقاط عطف مهم مانند نشستن و راه رفتن مستقل را بدست آورند ، بلکه برای برخی از نوزادان که قبل از علائم آنها تشخیص داده می شود ، ممکن است به عنوان یک درمان باشد"
هزینه ژن درمانی برای هر دوز 1.79 میلیون پوند است. بویزن ادامه داد: "همانطور که در بسیاری از روشهای درمانی جدید برای بیماریهای بسیار نادر وجود دارد ، شواهد محدود نشان می دهد که عدم اطمینان در مورد مزایای طولانی مدت زولگنسما وجود دارد."
مارک مک گرگور (کنسرسیوم داروهای اسکاتلندی) نتیجه گیری کرد: "ما انتظار داریم که صنعت داروسازی در جهت بهبود کارایی خود برای ارائه چنین نوآوری های پرهزینه با حداقل هزینه ممکن که برای پایداری سیستم های مراقبت بهداشتی در سراسر جهان ضروری است ، کار کند.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
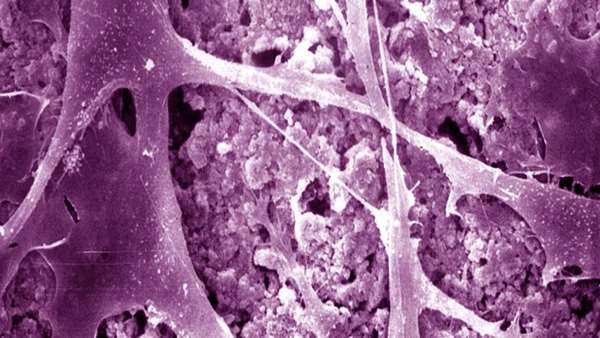
محققان دانشگاه اوزاکا (ژاپن) مکانیسم مولکولی را در سلول های بنیادی مغز استخوان کشف کردند که تولید آن ها را پس از شیمی درمانی بهبود می بخشید. این کشف برای اولین بار به تازگی در مجله Experimental Medicineبه چاپ رسیده است.
سلول های بنیادی خونساز (HSPC) باعث ایجاد انواع مختلفی از سلولهای ضروری خون می شود. این سلول ها به دلیل سرعت تقسیم ، به ویژه درمقابل درمان هایی مانند شیمی درمانی آسیب پذیر هستند. با این حال ، HSPC ها پس از آسیب دیدن توانایی بازسازی دارند.
ماسارو ایشی (ماسارو ایشی) (دانشگاه اوزاکا) اظهار داشت: "مغز استخوان عضوی بسیار فعال است زیرا مجبور است به طور مداوم سلول های خونی جدید تولید کند." "هنگامی که عملکرد خود را از دست داد ، مانند زمان شیمی درمانی ، ممکن است شرایط مهلکی مانند کم خونی ، نوتروپنی و خونریزی ایجاد شود. در این مطالعه ، ما می خواستیم درک کنیم که چگونه سلول های بنیادی خون ساز در مغز استخوان پس از آسیب ناشی از شیمی درمانی برای بازیابی عملکرد کامل خود، بازسازی می شوند. "
در مطالعه خود ، این تیم بر سلولهای لنفاوی ذاتی گروه 2 (ILC2s) ( زیرمجموعه سلولهای خونی که توسط HSPC تولید می شوند) تمرکز کرند. این سلول ها ، که برای سیستم ایمنی بدن و ترمیم بافت مهم هستند ، در مغز استخوان یافت می شوند با این حال ، عملکرد دقیق آنها همچنان نامشخص است.
در تلاش برای کشف نقش ILC2 در مغز استخوان ، تیم با استفاده از ماده شیمیایی 5-fluorouracil موش ها را تیمار کردند و سپس پیوند HSPC های آسیب ندیده را در موش ها انجام داد. نتایج نشان داد که HSPC ها تکثیر می یابند و در بازرسی بیشتر مشخص شد که ILC2 ها عامل تحریک کلنی گرانولوسیت-ماکروفاژ (GM-CSF) است که به روند بازسازی HSPC کمک می کند.
این تیم سپس به دنبال این بود که چرا ILC2 ها پس از شیمی درمانی GM-CSF تولید می کنند. با آزمایش های بیشتر ، آنها دریافتند که ILC2 های تولیدی توسط HSPC، با فعالیت اینترلوکین -33 (پروتئینی که توسط سلول های B تولید کننده آنتی بادی پس از آسیب آزاد می شود )، فعال می شوند.
توضیح این مکانیسم پیچیده مولکولی نشان داده است که ILC2s بهبودی HSPC را تسریع می کند و ممکن است به عنوان یک سنسور برای آسیب مغز استخوان عمل کند.
نویسنده این مطالعه ، Takao Sudo (دانشگاه اوزاکا) نتیجه گیری کرد: "این نتایج شگفت زده است که نشان می دهد مغز استخوان پس از شیمی درمانی بازسازی می شود." "نتایج ما ممکن است به توسعه یک رویکرد درمانی جدید برای سرکوب میلوما در اثر شیمی درمانی کمک کند."
Link: https://www.regmednet.com/how-does-bone-marrow-regenerate-following-chemotherapy/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

به دنبال همکاری مشترک بین یک گروه مستقر در مرکز تحقیقات سرطان آلمان و آزمایشگاه زیست شناسی مولکولی اروپا (هایدلبرگ ، آلمان) مطالعهای طراحی شد که به استفاده از سلولهای بنیادی القایی (IPSC)برای شناسایی تغییرات ژنتیکی در بیماریها نادر می پرداخت. نتایج این مطالعه که به تازگی در مجله Nature Genetics منتشر شده است، iPSC ها را به عنوان ابزاری بالقوه برای تجزیه و تحلیل انواع تغییرات ژنتیکی و به دنبال آن عملکرد سلول معرفی میکند.
سلولهای بنیادی القایی به سلول هایی گفته می شود که به واسطه فرآیندهای ازمایشگاهی،یک سلول کاملا تمایز یافته همچون سلول پوستی، به یک سلول بنیادی پرتوان تبدیل می شود.این فناوری که در دهه ی اخیر بسیار مورد توجه پژوهشگران قرار گرفته است،دریچه هایی از امید را به در حوزه های تشخیص، درمان گشوده است.
به منظور درک مکانیسم اثر تغییرات ژنتیکی همچون پلی مورفیسمها در بروز بیماریهای وراثتی، تلاشهای قابل توجهی صورت پذیرفت تا مشخص شود که در کدام بافتها می توان این بیماری را با تغییرات فعالیت ژن مرتبط کرد. این آزمایش ها به طور کلی در سلولهای خونی ویا با نمونه برداری از بافت انجام میشود.
الیور استگل (مرکز تحقیقات سرطان آلمان) توضیح داد: "سلولهای بنیادی پرتوان، در بسیاری از موارد برای این منظور مناسب هستند، زیرا آنها تمایز نیافته اند و بنابراین وضعیت اجدادی تمام سلولها را منعکس می کنند." "سلولهای بنیادی به منظور ریشهیابی بیماریهایی که در دوران جنینی رخ میدهند، میتواند موثرتر باشند."
در این مطالعه محققین با بررسی بیش از 1000 دادهی حاصل از توالی یابی سلولهای iPSC، مطالعه گسترده ای بر روی فعالیت بیان ژنی این سلولها انجام دادند. از بین همه ژنهای فعال در iPSC ها ، 67٪ آنها بیان ژنی متفاوتی را در بیماریهای ژنتیکی از خود نشان دادند که عمدتا به بیماریهای خاصی مانند بیماری عروق کرونر قلب و سرطان های ارثی مرتبط بودند.
مارک جان باندر ، نویسنده این تحقیق، اظهار داشت: "ما تعداد زیادی از ارتباطات بین زمینه بیماری ژنتیکی با بیان ژن در سلولهای iPSC گزارش کردیم و از این حجم زیاد تنوع شگفتزده شدیم" باندر ادامه داد: "چنین آزمایشاتی پیشتر غیرممکن بود، زیرا هیچ مجموعه کافی از ترانسکریپتوم مرجع از سلولهای iPSC وجود نداشت." این گروه در حال بررسی پتانسیل آنالیز ترانسکریپتوم iPSC برای ارزیابی تأثیر تغییرات ژنتیکی در تمایز سلولی هستند استفاده کرد."
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
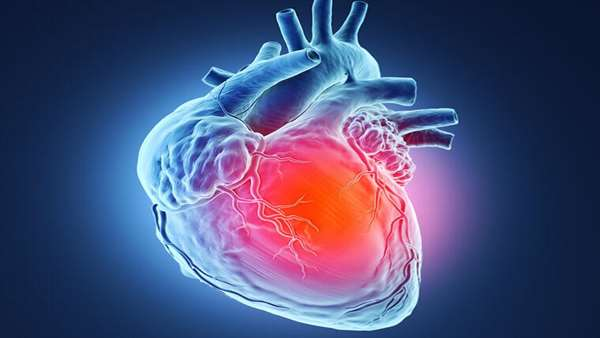
دانشمندان در موسسه تحقیقات پزشکی mount sinani آمریکا نشان داده اند که دسته ای از سلول های بنیادی مشتق شده از جفت که تحت عنوان سلول های cdx2 مثبت شناخته می شوند، می توانند سلول های قلبی را پس از حمله قلبی در مدل های حیوانی کاملا بازسازی کنند. تا قبل از این به نظر می رسید که سلول های cdx2 تنها مسئول تولید جفت در مراحل ابتدایی تکوین جنین هستند و توانایی بازسازی سایر ارگان ها را ندارند.نتایج حاصل از این آزمایش بسیار شگفت انگیز و خیره کننده بود زیرا در هیچ یک از آزمایشات بالینی که تا به حال بر روی درمان های قلبی انسان صورت گرفته، هیچ نوع سلول دیگری در پتری دیش به صورت سلول های قلبی دارای ضربان نبوده است و نکته جالب این بود زمانیکه این سلول ها به جریان خون تزریق می شدند به طرز هوشمندانه ای می دانستند که باید به کجا روند! این نتایج می تواند مسیر پزشکی بازساختی ارگان های دیگر را نیز هموار کند.
https://www.pnas.org/content/116/24/11786
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470




