سلول های بنیادی راهی به آینده
-
محققان یک وکتور لنتی ویروسی را برای ژن درمانی را طراحی کرده اند که میتواند به میزان قابل توجهی باعث افزایش هموگلوبینها نسبت به روش های رایج امروزی شود و در نتیجه می تواند برای درمان اختلالات خونی مانند سلول داسی شکل و بتا تالاسمی به صورت موثر تر مورد استفاده قرار بگیرد.
نتایج این مطالعه گویای مزایای بالقوه این رویکرد برای درمان موفقیت آمیز بیماران مبتلا به بتا-گلوبینوپاتی مانند بیماری سلول داسی شکل و بتا-تالاسمی است ، از جمله این مزایا میتوان به انتخاب دوز بهینه تر، احتمال به حداقل رساندن تومورزایی ، کاهش هزینه های درمان و همچنین نیاز بیمار برای شیمی درمانی و یا پرتودرمانی را قبل از شروع ژن درمانی کاهش می دهد. بتاگلوبینوپاتی ها اختلالات ناشی از جهش در ژن بتاگلوبین است که مسئول تولید هموگلوبین است. این پروتئین اساسی از گلوبین و چهار زیر واحد حاوی آهن تشکیل شده و اکسیژن را به بدن منتقل می کند.
لذا این ناقل طراحی شده در مطالعه حاضر با انتقال نسخه های سالم و عملکردی از ژن بتاگلوبین، برای اصلاح ناهنجاری در این اختلالات خونی مورد استفاده قرار میگیرد. به منظور دستیابی به این هدف ، این تیم تحقیقاتی با استفاده از یک لنتی ویروس مهندسی شده، یک ویرایشگر ژنومی جدید ایجاد کرد. همانند اقدامی که در مطالعات پیشین به کمک رترو ویروسها به منظور ژن درمانی در آزمایش های دیگر برای بتا-گلوبینوپاتی ها صورت گرفته بود.
همچنین در آزمایشات قبلی از لنتی ویروس هایی استفاده شده بود که حاوی ژن بتاگلوبین انسان همراه با پروموتر، سه سایت اصلی با برای رونویسی ژن مهم هستند و یک نسخه متراکم از اینترون شماره 2 را شامل می شدند. اما در این پژوهش از نسخه کامل اینترون برای طراحی لنتی ویروس استفاده شد که این امر باعث افزایش بتاگلوبین و در نتیجه بیان هموگلوبین می شود. از پنج وکتور جدید لنتی ویروسی ایجاد شده ، یکی به نام ALS20 نسبت به بقیه به طور قابل توجهی قدرتمندتر بود بطوریکه در مقایسه با وکتورهای رایج تا 157٪ هموگلوبین بیشتر در بزرگسالان بیان شد. بعلاوه ، ذرات ویروسی ALS20 حاوی هیچگونه محصولات جانبی ناخواسته RNA ژنومی نبودند و موشهایی که تحت درمان با ALS20 قرار گرفتند ، فیزیولوژی طبیعی را داشتند. این بدان معنی است که استفاده از روش درمانی جدید میتواند بی خطر در نظر گرفته شود. با توجه به مجموعه شواهد ارائه شده در این کار ، محققین معتقدند که ALS20 کاندیدای مناسبی برای درمان موفقیت آمیز بتا-گلوبینوپاتی است.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
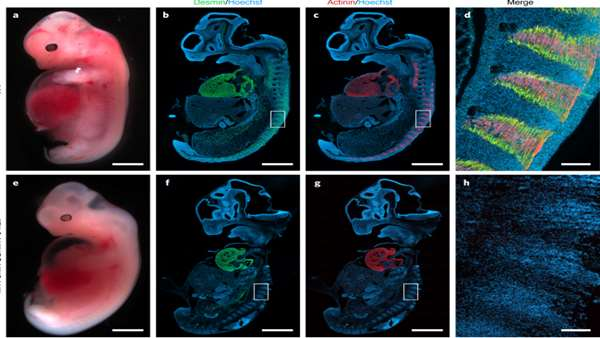
محققان انستیتوی قلب Lillehei دانشگاه Minneapolis آمریکا نشان دادند که کایمر انسان:خوک می تواند تولید اندام های برون زا را برای تحقیقات و پیوند گزنوگرفت تسهیل کند.
از آنجا که عضله اسکلتی انسان پس از مرگ قابل دوام نیست، به طور معمول پس از از دست دادن عضله به دلیل بیماری یا آسیب، پیوند عضله ی اتولوگ در بازسازی مورد نیاز است. با این حال، استفاده از بافت اتولوگ اغلب منجر به عوارض در محل دهنده بافت می شود. محققان انستیتوی قلب Lillehei دانشگاه Minneapolis آمریکا در پژوهشی که در مجله ی nature biomedical engineering منتشر کردند، نشان دادند که می توان با حذف ژن های MYF5 ، MYOD و MYF6 در جنین از طریق CRISPR و انتقال هسته ای سلول سوماتیک و تحویل سلول های برون زا (بلاستومرهای خوکی یا سلولهای بنیادی پرتوان القایی انسانی) از طریق تکمیل سازی بلاستوسیست، جنین های خوک کایمریک بین گونه ای یا درون گونه ای فاقد ماهیچه ی اسکلتی طبیعی ایجاد کرد.
کایمر های درون گونه ای تولید شده زنده بوده و بافت شناسی، ریخت شناسی و عملکرد طبیعی را نشان دادند. هر چند، کایمرهای انسان:خوک تولید شده با سلول های پرتوان القایی انسانی فاقد TP53 منجر به بهره وری بالاتر از کایمریسم گردید. محققان این پروژه اعلام کردند که جنین های جمع آوری شده در روزهای جنینی 20 و 27 حاوی عضله انسانی توسط تجزیه و تحلیل های ایمونوهیستوشیمی و مولکولی نیز تایید شدند.
https://www.nature.com/articles/s41551-021-00693-1#citeas
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
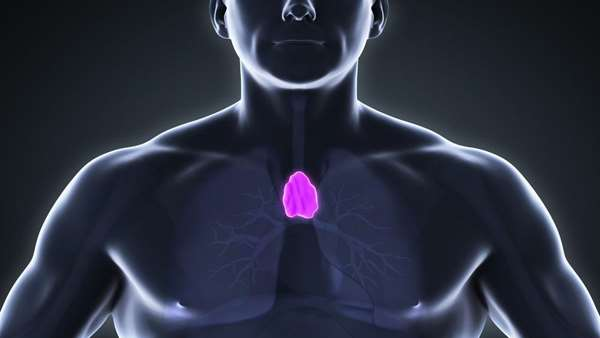
سال هاست که توجه زیادی به فرایندهای دخیل در تولید تیموس شده است و محققین بسیاری سعی در دستکاری این فرایندها در بالین داشته اند زیرا تغییرات در تکوین یا عملکرد تیموس می تواند منجر به نقص ایمنی و یا بیماری های خود ایمن شود.
در مطالعه ای جدید در انستیتو فرانسیس کریک، محققین سلول های هیبرید اپی تلیال-مزانشیم را شناسایی کرده اند که قادرند در شرایط آزمایشگاهی به صورت طولانی مدت تکثیر شوند و می توان از آن ها برای بازسازی و تولید یک فنوکپی آناتومیک از تیموس طبیعی استفاده کرد و البته برای این کار به سلول های بینابینی تیموسی و ماتریکس خارج سلولی سلول زدایی شده تیموس نیاز است. این تیموس مهندسی شده از نظر عملکردی فعال بوده و این قابلیت را دارد که از بلوغ سلول های T در شرایط درون تنی(بعد از پیوند به موش ناقص از نظر ایمنی) حمایت کند.
یافته های این مطالعه نشان دهنده ارتباط سلولی و مولکولی بین استروما، ماتریکس خارج سلولی و تیموسیت ها است و چشم اندازهای کاربردی را برای درمان بیماری های ایمونولوژیک اکتسابی و مادرزادی ارائه می دهد.
Reference:https://imms.kz/?q=en/news/869
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

کاربرد سلول های بنیادی خون قاعدگی در درمان ناباروری
دکتر سمیه کاظمنژاد- جنینشناس و عضو هیئت علمی مرکز درمان ناباروری ابنسینا و یکی از مجریان طرح «بانک سلولهای بنیادی خون قاعدگی» در این خصوص گفت:
ناباروری و عدم توانایی فرد برای انجام طبیعی فرآیند تولیدمثل و صاحب فرزند شدن به عنوان یکی از تجربیات تلخ و دردآور زندگی است که زمینه و شرایط روانی و اجتماعی نیز می تواند به اهمیت آن بیفزاید و آن را برای فرد تبدیل به یک بحران نماید. ناباروری همچنین موجب افزایش اختلالات و ناسازگاری های جنسی می شود و رضایت جنسی و تعداد دفعات فعالیت جنسی را کاهش می دهد، به طور کلی زنان نابارور بیشتر از مردان در معرض عوامل تنش زای جسمی، روانی و اجتماعی ناشی از ناباروری و درمان آن قرار دارند.
در سال های اخیر عواملی نظیر تغییر نقش زنان در فعالیت های اجتماعی، تأخیر در سن ازدواج، تغییر در سن داشتن فرزند، افزایش استفاده از روش های پیشگیری از باروری، آزاد شدن سقط جنین و وضعیت اقتصادی نامطلوب، باعث کاهش میزان باروری درکشورهای صنعتی شده است. شیوع ناباروری در دهه اخیر به طرز چشمگیری افزایش یافته است به طوری که میزان آن در کشورهای صنعتی حدود 10 تا 15 درصد گزارش شده است و طبق آخرین گزارش ها شیوع ناباروری در کشورمان ایران نیز 15 درصد برآورد شده است.
از دست رفتن عملکرد تخمدان معمولا فرایندی تدریجی است که در طول چند سال شکل می گیرد و منجر به یائسگی می شود. در نارسایی زودرس تخمدان که به آن یائسگی زودرس (Premature Ovarian Failure, POF) نیز گفته می شود، عملکرد طبیعی تخمدان قبل از 40 سالگی دچار اختلال می شود که این اختلالات در نهایت منجر به قطع تخمک گذاری و قطع عادت ماهیانه می شود. در گروه دیگری از بیماران نابارور با وجودی که یائسه نیستند ولی با پاسخ دهی ضعیف تخمدان به داروهای تحریک تخمدانی مواجهند (Poor Ovarian Response, POR) و بیشتر آنها در نهایت کارشان به استفاده از روشهای اهدا جهت فرزنددار شدن می انجامد. در این بیماران با کاهش ذخیره تخمدانی ممکن است هنوز قاعدگیها و تخمکگذاری منظم وجود داشته باشد، ولی به دلیل کاهش کیفیت تخمکها دچار ناباروری یا نازایی هستند. بسیاری از این خانمها دچار نامنظمی چرخههای قاعدگی میشوند و ممکن است برخی هم از اول با مشکل نازایی مراجعه کنند. همچنین برخی بیماران ممکن است به طور حاد با قطع شدن قاعدگی مراجعه کنند یا ابتدا دچار چرخههای طولانی قاعدگی شوند.
در تحقیقات جدید نشان داده است که کاهش ذخیره تخمدانی اصولا به دلیل پیری نیچ تخمدانی اتفاق می افتد و سلول های بنیادی با توجه به قابلیت تکثیر و تمایز بالای خود می توانند در ترمیم نیچ تخمدانی موثر باشند. در مطالعات مختلف کلینیکال ترایال از انواع سلول های بنیادی برای درمان این اختلالات تخمدانی استفاده شده است. با توجه به قابلیت سلول های بنیادی مشتق از خون قاعدگی در ترمیم بافت های مختلف در مطالعه ای از این سلول ها برای درمان نارسایی تخمدان در مدل موشی استفاده کرده اند.
همزمان با این مطالعات در سراسر جهان، مطالعات متعددی در دهه گذشته بر روی جنبه های مختلف درمانی سلول های بنیادی مشتق از خون قاعدگی توسط تیم تحقیقاتی حاضر صورت گرفته است و خصوصیات، ویژگیها و قابلیت های سلولهای بنیادی خون قاعدگی بررسی شده است.
امروزه استحصال سلول بنیادی از منابع مختلف از جمله جنین، مغز استخوان، خون بند ناف و خون محیطی به منظور دستیابی به سلول های بنیادی چند توان، زمینه ساز تحقیقات بسیاری می باشد و دریچه جدیدی را برای درمان بیماری های مختلف گشوده است. ملاحظات اخلاقی استفاده از سلول های بنیادی جنینی، سبب محدودیت کاربرد آنها و معطوف شدن نظر جامعه پزشکی به سمت منبع سلولهای بنیادی مثل مغز استخوان شده است. هدف عمومی از این روند، تحصیل سلول های متمایز به منظور تهیه بافتهای مختلف در فضای آزمایشگاه و رفع نیاز به پیوند بافت از فردی به فرد دیگر و نیز رفع مشکلاتی چون عوارض رد پیوند و هزینه های متعدد آن می باشد.
در سال های اخیر به دلیل ترمیم بالای اندومتر در هر سیکل قاعدگی، خون قاعدگی به عنوان یکی از منابع سلولهای بنیادی معرفی شده است. خون قاعدگی بافت آندومتر یک منبع غنی از سلول های بنیادی چند توان است که به آسانی در هر سیکل قاعدگی از دست می رود، این در حالی است که علاوه بر دسترسی آسان ماهیانه و عدم تهاجمی بودن روش جمع آوری خون قاعدگی، سلولهای بنیادی مشتق از این منبع توانایی تکثیر و تمایز فوق العاده ای دارند.
امید است با تولید این فراورده سلولی بیولوژیک در کشورمان با صرف هزینه های کمتر نسبت به سایر روش های کمک باروری، برای زوجین نابارور امکان استفاده از این روش درمانی نوین فراهم شود و بسیاری از آن زوجینی که به علت مشکلات مالی از فرزندآوری منصرف می شوند، تشویق به استفاده از این محصول سلول درمانی شوند.
از طرفی استفاده از این محصول بیولوژیک با افزایش تعداد و کیفیت تخمک های بالغ در تخمدان و نیز افزایش ضخامت اندومتر، شانس وقوع بارداری خودبه خودی در زوجینی که از این چنین اختلالاتی رنج می برند ، افزایش خواهد یافت.
همچنین تزریق این فراورده سلولی موجب بهبود شرایط محیط تخمدانی و نیز شرایط لانه گزینی جنین می شود و در نتیجه درصد موفقیت در روش های پیشرفته کمک باروری مانند IVF متعاقب سلول درمانی افزایش می یابد.
بنابراین، سلول های بنیادی مشتق شده از خون قاعدگی در مقایسه با سایر سلولها مزایای متعددی دارد و گام جدیدی را در سلول درمانی بیماریهای مختلف باز کرده است و می تواند نیازهای بالینی را برطرف سازد.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
محققین بر مبنای مطالعات حیوانی روی عفونت های ویروسی اطلاعاتی را در مورد سلول های CD8 T تحلیل رفته بدست آورده اند. در حضور ویروس یا سرطان سلول های CD8 T توانایی شان برای مبارزه با سرطان را از دست می دهند و پروتئین های مهار کننده چک پوینت مانند PD-1 را روی سطح شان نشان می دهند. پروتئین PD-1 بوسیله داروهای ایمنی درمانی سرطان مانند pembrolizumab و nivolumab هدف قرار می گیرد و این امر به سلول های CD8 T اجازه می دهد که توانایی شان برای حمله کردن و کشتن سلول های سرطانی آلوده را مجددا بدست بیاورند. این داروها برای درمان سرطان های متعدد مورد تایید FDA هستند ولی برخی از تومورها به آن ها پاسخ نمی دهند. مطالعه روی سلول های CD8 T تحلیل رفته می تواند به درک بهتر عملکرد سیستم ایمنی علیه سرطان و عفونت های مزمن کمک کند.
هم چنین این مطالعه مرحله گذاری را بین سلول های شبه بنیادی و سلول های واقعا تحلیل رفته نشان می دهد. سلول های واقعا تحلیل رفته بوسیله مولکولی به نام CD101 مشخص می شوند و قادر به مهاجرت به جایگاه عفونت نیستند و حاوی مقادیر اندکی از پروتئین های مورد نیاز برای کشتن سلول های آلوده و توموری هستند. در واقع این سلول های CD8 T هنوز هم قادر به تکثیر و انجام عملکردهای کشندگی شان هستند و مطالعات نشان داده اند که آن ها می توانند در کنترل ویروس نقش بازی کنند. سلول های گذرا که فاقد CD101 هستند می توانند مارکر خوبی برای پاسخ به داروهای بلوک کننده PD-1 باشند. تقویت تکثیر یا بقای این سلول ها یا مهار گذار آن ها به یک تحلیل رفتن طولانی می تواند یک استراتژی درمانی جدید برای سرطان باشد.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
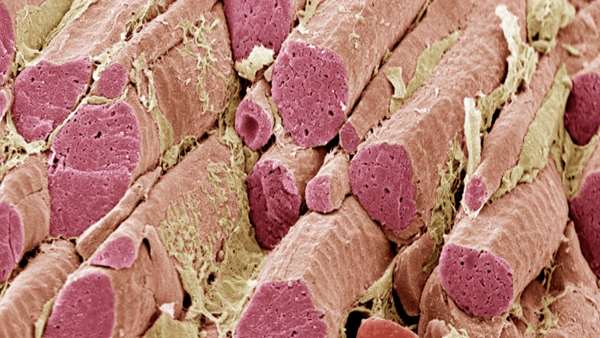
در تلاش برای بازگرداندن عضله از دست رفته، محققان موسسه Wake Forest for Regenerative Medicine (NC, USA) ، دانشگاه Sungkyunkwan (سئول ، کره جنوبی) و دانشگاه ملی Chonnam )کره جنوبی، (Gwangju یک تکنیک مهندسی زیستی کارآمد را برای بازسازی عضلات و بازگشت عملکرد آنها در ترمیم موشهای آسیب دیده ایجاد کرده اند که نتایج مطالعه آنها در Applied Physics Review منتشر شده است.
غالباً در صورت عدم وجود روشهای بازسازی موثر برای مهندسی زیستی عضلات اسکلتی، از دست دادن عضله در اثر ضربه، بیماری یا آسیب می تواند باعث آسیب دائمی در آن ناحیه شود.
آنها با گسترش روش قبلی خود با استفاده از Muscles-specific materials مشتق شده از بافت (dECM-MA) برای ساختن bioinks ، یک گروه برای تولید ترکیب بیوشیمیایی و توپوگرافی برای پرداختن به این موضوع را ایجاد کرده اند.
این تیم با ترکیب dECM-MA از عضلات اسکلتی خوک و پلی یوینیل الکل (PVA) یک جوهر زیستی که آنها را به سمت بافت هدف هدایت می کند را تهیه کرده اند. با بهینه سازی PVA برای ایجاد ساختارهای سلولی پایدار و مناسب، بهبودهای چشمگیری در بازسازی عضلات و ترمیم عملکرد مشاهده شد.
سانگ جین لی، یکی از محققان این پروژه، توضیح داد: "یک مزیت عمده ی این روش نسبت به رویکردهای قبلی، هم ترازی و هم راستایی سلولهای عضلانی در ساختار سه بعدی بدون هیچ گونه مولفه پشتیبانی کننده است." "این می تواند به ما امکان ایجاد ساختارهای عضلانی مهندسی زیستی مربوط به کلینیک را بدهد."
به محض آزمایش این روش روی عضلات آسیب دیده ی پاهای موش، در موشهای تحت درمان با این روش جدید بیش از 80٪ ترمیم عملکرد عضلانی در مقایسه با موشهای هم سن و سال و موشهایی با همان آسیب که هیچ درمانی نداشتند، مشاهده شد. علاوه بر این ، عضلات مهندسی زیستی به خوبی با سیستم عصبی و عروقی موش ها ادغام شدند.
این نتایج نشان می دهد که ترکیب dECM-MA با PVA می تواند یک راه حل بالینی برای دستیابی به بازسازی بافت در مقیاس بزرگ ارائه دهد.
لی اظهار داشت: "این رویه پیشرفته چاپ بیولوژیکی برای مهندسی زیستی سازه های عضلانی اسکلتی عملکردی می تواند یک گزینه درمانی موثر برای درمان آسیب های گسترده نقص عضلانی باشد."
با توجه به اینکه این امر نیاز به تهیه سلول از بیمار دارد، این تیم در ورود این فناوری به کلینیک برخی مشکلات را پیش بینی می کند. در حال حاضر، آنها در حال برنامه ریزی برای آزمایشات بالینی بیشتری بر روی ساختارهای عضلانی بزرگتر در حیوانات بزرگتر هستند.
SOURCE
Lee H, Kim W, Lee J et al. Self-aligned myofibers in 3D bioprinted extracellular matrix-based construct accelerate skeletal muscle function restoration. Appl. Phys. Rev. 8, 02145 (2021).
https://www.regmednet.com/novel-bioengineering-approach-could-aid-muscle-regeneration/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
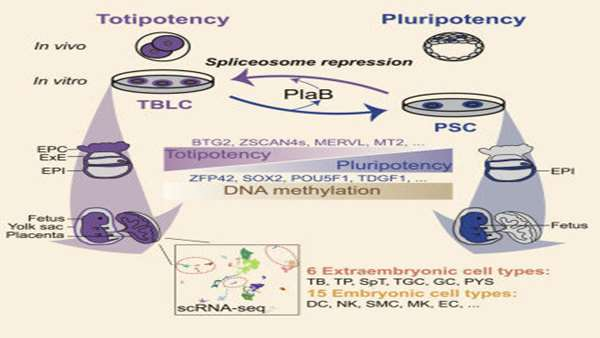
Hui Shen و همکارانش در 14 می سال 2021 در مجله ی Cell، گزارشی را منتشر کردند که در آن روشی برای جذب و نگهداری سلولهای بنیادی همه توان پیشنهاد شده است.
از زمانی که برای اولین بارسلولهای بنیادی جنینی (ESC) ایجاد شدند، مقایسه ی عملکردی و مولکولی پتانسیل رشد جنینی و خارج جنینی در کشت in vitro سلولهای همه توان و بلاستومرهای داخل بدن چالش برانگیزبوده است. محققان این پروژه گزارش داده اند که سرکوب پیرایش ژنی در ESC های موش باعث ایجاد یک حالت حدواسط pluripotent به totipotent می شود. Shen و همکارانش با استفاده از مهارکننده ی پیرایش ژنی، پلادینولید B، توانسته اند به کشت in vitro پایدار ESC های همه توان برسند که در سطوح مولکولی قابل مقایسه با بلاستومرهای 2 و 4 سلولی است، به همین علت این سلولها را سلول های شبه بلاستومر قدرتمند (TBLC) نامیده اند.
سنجش های کایمریک موش همراه با توالی یابی RNA تک سلولی (scRNA-seq) نشان داده که TBLC ها دارای توانایی رشد دو طرفه ی قوی برای تولید دودمان سلول های جنینی و خارج جنینی متعددی هستند. سرکوب پیرایش ژنی باعث مهار گسترده ی پیرایش در ژنهای پر توان( pluripotent genes) می شود، هرچند ژنهای همه توان( totipotent genes ) که حاوی تعداد کمی از اینترونهای کوتاه هستند، به طور موثر پیرایش شده و از نظر رونویسی فعال می شوند. این مطالعه روشی را برای بدست آوردن و نگهداری سلولهای بنیادی توانمند فراهم می کند.
https://www.cell.com/cell/fulltext/S0092-8674(21)00500-6
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

محققین آجرهای توخالی کوچک الهام گرفته شده از بلوک های لگو را تولید کرده اند که می توانند به عنوان داربستی برای بازسازی و رشد بافت های نرم و سخت استفاده شوند. هر کدام از این آجرها به صورت مکعب های تقریبا یک و نیم میلی متری هستند. این آجرها، شبیه آجرها یا بلوک های لگو می توانند به هم چسبیده شوند و به صورت هزاران شکل یا کانیفیگوراسیون مختلف با اندازه های مختلف و مناسب با بافت هدف در آیند.
در حال حاضر، جراحان و ارتوپدیست ها شکستگی های استخوانی بزرگ را با ایمپلنت کردن میله ها یا صفحات فلزی برای تثبیت استخوان و در ادامه وارد کردن مواد داربست ساز زیست سازگار ترمیم می کنند که این رویکرد با مشکلات مختلفی همراه است. اما استفاده از آجرهای پرینت شده موجب ایجاد یک داربست توخالی می شود که با مقادیر اندکی ژل حاوی فاکتورهای رشد مختلف پر شده است و می تواند به طور دقیق در جایگاه مورد نیاز قرار داده شود. استفاده از این آجرهای مملو از فاکتورهای رشد در مدل رتی شکستگی استخوان موجب رشد تقریبا سه برابری عروق خونی در مقایسه با داربست های متداول شد. همین افزایش رگزایی و ویژگی های فضایی این آجرهای پرینت شده موجب تقویت فرایند استخوان سازی در مقایسه با روش های معمول شد.
Reference:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202001736
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

در پژوهشی جدید محققین نشان داده اند که کشت سلول های قلبی در فضا موجب تغییر در بیان ژن های آن ها می شود، اما تنها 10 روز بعد از برگرداندن این سلول ها به شرایط کشت روی کره زمین، این سلول های قلبی به شرایط طبیعی باز می گردند. در این پژوهش جدید، محققین در دانشگاه کالیفرنیا از سلول های بنیادی پرتوان القایی انسانی برای مطالعه اثر سفر فضایی یا شرایط عدم جاذبه روی عملکرد قلب انسانی استفاده کردند. بی وزنی، عدم جاذبه یا اصطلاحا microgravity، محیطی است که از منظر اثر آن روی بدن انسان به میزان بسیار زیادی ناشناخته باقی مانده است و مطالعاتی از این دست می تواند اطلاعات جدیدی را در این زمینه ارائه دهد.
مطالعات گذشته نشان داده اند که سفرهای فضایی منجر به شروع تغییراتی در عملکرد قلبی از جمله تغییر در ضربان قلب، فشار شریانی پایین تر و برون ده قلبی بالاتر می شود اما در مورد اثر بی وزنی روی عملکرد قلب انسان در سطح سلولی اطلاعات کمی موجود است. این مطالعه با نشان دادن تغییر بیان ژن ها در این شرایط، دیدگاه هایی را در مورد مکانیسم های سلولی ارائه داده است که درک هر چه بهتر و بیشتر آن ها می توان به سلامت فضانوردان در سفرهای طولانی مدت کمک کند و یا دیدگاه های جدیدی را در زمینه بهبود سلامت قلب روی زمین ارائه دهد. محققین برنامه دارند که درمان های مختلفی را روی سلول های قلبی انسانی در شرایط بی وزنی تست کنند تا شاید بتوانند راهی برای جلوگیری از این تغییرات بیابند.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

محققان دانشگاه لوند در سوئد یک جوهر زیستی جدید طراحی کرده اند که اجازه می دهد مجاری تنفسی کوچک انسانی برای اولین بار با کمک سلول های بیمار به صورت سه بعدی چاپ شود. سازه های چاپ شده ی سه بعدی زیست سازگار بوده و از رشد رگ های خونی جدید نیز پشتیبانی می کنند. این اولین قدم مهم به سمت ارگان های چاپ سه بعدی است. این مطالعه در Advanced Materials منتشر شده است.
جوهر زیستی که این محققان برای چاپ سه بعدی زیستی انسان طراحی کرده اند از ترکیب دو ماده ساخته شده است: ماده ای مشتق شده از جلبک دریایی، آلژینات و ماتریس خارج سلول مشتق شده از بافت ریه.
این جوهر زیستی جدید در چندین مرحله ی مختلف از تکامل سلول های بنیادی به سمت بافت کمک می کند. از این جوهر زیستی برای چاپ سه بعدی راههای هوایی کوچک انسان حاوی دو نوع سلول موجود در مجاری تنفسی انسان استفاده شده است. هر چند، این جوهر زیستی می تواند برای هر نوع بافت یا عضوی سازگار باشد.
به گفته ی دارسی واگذر که از محققان این پروژه است، این جوهر های زیستی جدید از بلوغ سلول های بنیادی راه هوایی به انواع مختلف سلول که در مجاری تنفسی انسان بالغ یافت می شوند، پشتیبانی می کنند، به این معنی که انواع سلول و تعداد نازل کمتری برای چاپ بافت از سلول های مختلف مورد نیاز می باشد.
همچنین، واگذر به این نکته نیز اشاره کرده است که لازم است کیفیت چاپ سه بعدی به بافت ریه و کیسه های هوا (معروف به آلوئول) که برای تبادل گاز حیاتی هستند نزدیکتر شده و بهبود یابد.
این تیم تحقیقاتی از یک مدل موش سرکوب ایمنی شده بسیار شبیه با بیماران تحت پیوند اعضا استفاده کردند. آنها هنگام پیوند دریافتند که سازه های چاپ سه بعدی ساخته شده از جوهرزیستی جدید به خوبی توسط بدن تحمل شده و از رگهای خونی جدید نیز پشتیبانی می کنند.
مارتینا دی سانتیس، نویسنده ی اول این مطالعه، اینطور نتیجه گیری می کند که توسعه این جوهر زیستی جدید یک گام قابل توجه به سمت جلو می باشد، اما اعتبار سنجی بیشتر عملکرد مجاری هوایی کوچک در طول زمان و بررسی امکان سنجی این روش در مدل های حیوانات بزرگ نیز باید صورت گیرد.
https://www.sciencedaily.com/releases/2021/03/210317111755.htm
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
تاکنون نتایج بدست آمده نشان داده بود که تزریق سلول های قلبی آلوژن موسوم به سلول های مشتق از کاردیوسفیرها(CDCs) قادر به کاهش میزان بافت اسکار بر جای مانده روی عضلات قلبی در نتیجه حمله قلبی نیست اما ارزیابی های بیشتر حاکی از مفید بودن این رویکرد بوده است. در این پژوهش بالینی جدید، در مقایسه با بیمارانی که پلاسیبو(دارونما) را دریافت کردند، بیمارانی که CDCs را دریافت کردند، بعد از هر ضربان قلب میزان خون بیشتری پمپاژ می کردند و حجم خون باقی مانده در قلب شان کمتر بود که نشان دهنده این امر بود که قلب آن ها دچار اتساع و در نتیجه نارسایی نشده است.آنالیزهای جدید نشان داده است که بیمارانی که پلاسیبو یا دارونما را دریافت کردند قلب شان شروع به متورم شدن کرد و میزان خون بیشتری را بعد از هر ضربان در خود نگه می داشتند اما در بیمارانی که تزریق CDCs را دریافت کردند، قلب کوچکتر با حجم خون باقی مانده کمتری را دارا بودند. به عقیده محققین، علی رغم قضاوت زودهنگام در مورد تاثیر سلول درمانی روی بیماران مبتلا به حمله قلبی،این سلول درمانی امیدوار کننده بوده است و نتایج خوبی را نشان داده است که می تواند با بهینه سازی منجر به رویکردی موثر برای درمان بیماران قلبی شود.
REFERENCE:https://www.cedars-sinai.org/newsroom/covid-19-patients-improve-after-heart-cell-therapy/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

آتروفی اپتیک غالب(DOA) با تخریب اعصاب چشمی مشخص می شود و در ابتدای بلوغ موجب بروز علایمی در بیماران می شود که از جمله آن ها می توان به از بین رفتن تدریجی بینایی و نقص در تشخیص رنگ و ... اشاره کرد که می تواند در نهایت منجر به نابینایی شود و متاسفانه درمان موثری برای این مشکل وجود ندارد. ژنی به نام OPA1 دستورالعمل هایی را برای تولید پروتئین ایجاد می کند که در سلول ها و بافت های سراسر بدن یافت می شود و برای حفظ عملکرد مناسب میتوکندری ها حیاتی است.
بدون وجود OPA1، عملکرد میتوکندریایی به طور مناسبی صورت نمی گیرد و روی ارتباطات سلولی اثرات منفی می گذارد. در مورد بیماران مبتلا به آتروفی اپتیک غالب، جهش در ژن OPA1 و عملکرد نامناسب میتوکندریایی موجب شروع بیماری و پیشرفت در آن می شود. در مطالعه ای جدید در دوبلین، محققین ژن درمانی جدیدی را ارائه کرده اند که با اصلاح موتاسیون OPA1 می تواند عملکرد میتوکندریایی را بهبود بخشیده و با تقویت توانایی تولید انرژی از آسیب سلول های عصب بینایی جلوگیری کند. به عقیده آن ها این رویکرد درمانی می تواند با گذشت زمان و برطرف کردن چالش ها برای درمان آتروفی اپتیک غالب و سایر بیماری های چشمی موثر باشد.
https://medicalxpress.com/news/2020-11-scientists-gene-therapy-eye-disease.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

محققان دانشگاه UCLA کالیفرنیا ، ایالات متحده آمریکا و بیمارستان بزرگ اورموند لندن به منظور استفاده از روشی جدید مبتنی بر ژن درمانی برای درمان نقص ایمنی شدید ترکیبی (حاصل از کمبود آدنوزین دآمیناز ) همکاری کرده اند
این مطالعه که در مجله پزشکی نیوانگلند منتشر شده است ، نتایج 50 کودک 2 تا 3 ساله را که تحت آزمایش های بالینی بین سال های 2012 و 2017 قرار داشتند را گزارش می کند.
رویکرد ژن درمانی مورد استفاده در این مطالعه شامل حذف سلول های بنیادی خون ساز از بیماران و استفاده از وکتور مبتنی بر لنتی ویروس ها برای ارائه یک نسخه کاربردی از ژن ADA بوده است که به دنبال آن سلولهای بنیادی به بیماران مجددا پیوند شده توانایی ایجاد سلولهای ایمنی سالم را دارند. برخی از کودکان سلولهای منجمد شده و برخی دیگر سلولهای غیر منجمد دریافت کردند.
از 50 کودک درگیر در این آزمایشات، بعد از دنبال کردن آن ها به مدت 2-3 سال بعد ، 48 مورد هیچ علامتی از اختلال نقص ایمنی را نشان ندادند که این امر به نظر نمی رسد انجماد سلول های بنیادی بر نتایج تأثیر بگذارد.
نویسنده تحقیق ، آدریان تراشر توضیح داد که:"ما حدود 20 سال پیش ژن درمانی را در بیمارستان بزرگ اورموند آغاز کردیم و اکنون فرآیند را برای ارائه یک درمان بالقوه برای کودکان متولد شده با این بیماری ناتوان کننده اصلاح کرده ایم. بیش از 200 بیمار با شرایط مختلف ژنتیکی در سراسر جهان اکنون با این نوع ژن درمانی تحت درمان قرار گرفته اند - این یک موفقیت بسیار مهم دیگر است. "،
در دو مورد دیگر ، کودکان به درمان های استاندارد فعلی ادامه می دهند که معمولاً تزریق منظم آنزیم های ADA است. در یک مورد ، کودک پیوند مغز استخوان را انجام داد.
"اگر در آینده مورد قبول واقع شود، این روش درمانی می تواند برای ADA-SCID و به طور بالقوه بسیاری دیگر از شرایط ژنتیکی استاندارد باشد، دغدغه به یافتن اهدا کننده همسان برای پیوند مغز استخوان و عوارض جانبی آن که اغلب با آن درمان همراه است را برطرف می کند." کلر بوث، نویسنده اصلی این مطالعه اذعان داشت: "ما نیاز داریم و می خواهیم دستورالعمل هایی تغییر کند تا بتوانیم این درمان بالقوه را به کودکان ارائه دهیم و آن را به عنوان یک درمان انتخاب اول ارائه دهیم. این تحقیق شاید بتواند چرخ را به حرکت درآورد."
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
رشد سلولها در آزمایشگاه به عنوان کشت سلول شناخته می شود. سلولهای بنیادی می توانند در محیط های آزمایشگاهی در یک ظرف کشت حاوی یک ماده مغذی مغذی معروف به محیط کشت که برای رشد انواع مختلف سلول های بنیادی بهینه شده است تکثیر یابند.
کشت سلول شامل مجموعه ای از فرآیندهای جداسازی سلول از محیط طبیعی آنها و ادامه رشد در یک شرایط مصنوعی محیطی کنترل شده است. سلولها از بافتها یا اندامهای خاص به صورت رده های سلولی کوتاه مدت یا تثبیت شده کشت می شوند که به طور گسترده ای برای پژوهش و درمان مورد استفاده قرار می گیرند.
فناوری کشت سلول به ویژه در زمینه عفونتهای ویروسی کاربردهای فراوانی دارد. کشت سلولی محیط لازم را برای شناسایی عوامل بیماریزای بی شماری در انسان فراهم میکند.
پیشرفت فناوری در سالهای اخیر، توسعه آنتی بادیهای مونوکلونال و فناوریهای مولکولی، یک روش مهم برای تشخیص حضور عفونت ویروسی فراهم میکند. این روشها همچنین به عنوان یک پایه اصلی برای انجام آزمایشات سریع بر روی عوامل بیماریزای تازه کشف شده استفاده میشوند.
ترکیبی از جداسازی ویروس در کشت سلولی و روشهای مولکولی هنوز هم در شناسایی ویروس هایی که قبلاً شناخته نشده بودند حیاتی است. بنابراین، کشت سلول باید به عنوان یک روش اساسی در شناسایی عامل ویروسی عفونی مشکوک در نظر گرفته شود.
تکنیک کشت سلول برای اولین بار در اوایل قرن بیستم به عنوان روشی برای مطالعه رفتار سلول های حیوانی در شرایط آزمایشگاهی توسعه یافت. کشت سلولی به عنوان حذف سلولهای حیوانی و تکثیر و پرورش آن در شرایط آزمایشگاهی در یک محیط مصنوعی مناسب برای رشد تعریف شده است.
توانمندی در شناخت بیماریها
جداسازی ویروس در یک کشت سلولی بسیار طولانی است و زمان زیادی را میطلبد. کشت سلولی بسیاری از ویروسهای مهم هنوز هم دشوار است یا ناممکن، روندی که گاهی نیازمند یک سیستم کشت پیشرفته است.
پیشرفت های اخیر فناوری سلولی، کشت سلولی را با تکنیکهای تعیین توالی، امکان تجزیه و تحلیل ژن میکروارگانیسم بدون جداسازی ویروس از طریق را فراهم کرده است. این کار از طریق تعیین توالی پربار با استفاده از محصول DNA شده و مقایسه توالی ها با بانک گسترده ای از توالی ها برای شناسایی نهایی عامل شناسایی شده انجام میشود.
در بیماران شدید یا شیوع بیماریهای عفونی، شناسایی عامل ایجاد کننده عفونت مهم است. بدین ترتیب کشت سلولی میتواند با توالی یابی و شناخت ریشه و منشأ بیماری، به درمان و ریشهکن شدن آن کمک کند. شناسایی بیماری های در حال ظهور، با استفاده از روش تشخیص آزمایشگاهی اضافی مانند میکروسکوپ الکترونی ، تکنیکهای سرولوژی و مولکولی انجام می شود.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

دوازدهمین دوره مدرسه تابستانی بینالمللی پژوهشگاه رویان در تاریخ 2 الی 5 مرداد ماه سال جاری با موضوع " محصولات پیشرفته پزشکی" با رویکرد "کاربرد علوم زیستی" برای دانشجویان/ اساتید دانشگاه/ مدیران با رشتههای مرتبط و با سخنرانی اساتید برجسته ملی و بینالمللی از کشورهای مختلف در دو مرحلهی آموزشی و کارگاههای عملی مرتبط، طی چهار روز به صورت مجازی ارائه میشود. دوازدهمین مدرسه تابستانی به جدیدترین موضوعات در حوزه سلول درمانی با هدف آشنایی با محصولات پیشرفته درمانی و دارویی در حوزه مهندسی بافت، سلول و ژن درمانی، معرفی محصولات تجاری داخلی و بینالمللی در این حوزه، همچنین کنترل و تضمین کیفیت در تولید محصولات پیشرفته پزشکی میپردازد.
سرفصل های دوازدهمین مدرسه تابستانی بینالمللی پژوهشگاه رویان عبارتند از:
محصولات سلول درمانی
محصولات ژن درمانی
محصولات مهندسی بافت
تولید صنعتی، کنترل کیفیت و تضمین کیفیت محصولات پیشرفته پزشکیهمچنین با افتخار اعلام میدارد در مدرسه تابستانی امسال مسابقه "ایده شو" با عنوان فراخوان جذب ایده با موضوع "محصولات فناورانه و نوآورانه سلول درمانی، ژن درمانی، مهندسی بافت" که با هدف تشویق هر چه بیشتر صاحبان ایده و دانشجویان و نیز ارتقای ایدههای خلاقانه آنها در خصوص تولید و توسعه محصولات پیشرفته پزشکی، تشویق و افزایش مهارتهای کاربردی و خلاقانه افراد، علیالخصوص دانشجویان در حال تحصیل در چگونگی اجرایی کردن ایدههای خود، برگزار میگردد. این رویداد با هدف ترویج فرهنگ ایدهپردازی و از سویی ایجاد فضای رقابتی صمیمی برای معرفی ایدهها برگزار خواهد شد تا افراد بتوانند علاوه بر آموزش نحوه معرفی ایده، با نقد و بررسی آن توسط داوران متخصص به اجرایی کردن آن بپردازند. این رویداد ضمن بالا بردن اعتماد به نفس ایدهپردازان، آمادگی معرفی ایده در زمان کوتاه برای قانع کردن سرمایهگذاران و تشویق آنها برای سرمایهگذاری را ایجاد میکند. لذا پس از ثبت ایدهها برای فراخوان اولیه "ایده شو" در سامانه معاونت آموزشی پژوهشگاه رویان (اختصاصی رویداد ایدهشو)، با انجام داوری ایدههای ارسال شده توسط تیم داوران علمی و متخصص، ۱۰ ایده/محصول برگزیده به مرحله بعد راه خواهند یافت. سپس هر یک از صاحبان ایدهها/محصولات منتخب، طی 15-10 دقیقه ایده خود را ارائه و معرفی خواهد کرد. در این مرحله ، از 10 تیم/ایدههای ارائه شده، 5 ایده برتر انتخاب خواهند شد که پس از تکمیل بوم-مدل کسب و کار در روز پایانی، هر عضو منتخب با تاکید بر پارامترهای موجود در بوم طی 30-15 دقیقه و به صورت حضوری در محل پژوهشگاه رویان به ارائه ایده/محصول خود با حضور سایر تیمها، داوران و سرمایهگذاران، میپردازد. برای تشویق و ترغیب هرچه بیشتر شرکتکنندگان و اعضای تیم ایدهپرداز، علاوه بر اعطاء جایزه نقدی به بهترین تیم، کمکهایی غیرنقدی از قبیل در اختیار قرار دادن آموزشهای لازم جهت تجاری کردن محصول و توصیهنامه برای معرفی به سرمایهگذاران جهت اجرایی نمودن طرح، تعلق میگیرد.
اهداف "ایده شو":
شناسایی افراد صاحب ایده و تخصص جهت بهبود تیمسازی در مجموعه
شناسایی توانمندیها و فراهم کردن زمینه بروز و شکوفایی استعدادهای نهفته
توسعه فرهنگ کارآفرینی در راستای اهداف اقتصاد مقاومتی و دانش بنیان و رسالت علمی و اجتماعی مرکز توسعه فناوری محصولات پیشرفته پزشکی رویانهمچنین دوازدهمین مدرسه تابستانی پژوهشگاه رویان در نظر دارد به موازات برنامه دانشجویی، در بخش دانشآموزی نیز با هدف آموزش و آشنایی بیشتر دانشآموزان علاقهمند به حوزههای سلولدرمانی، ژن درمانی و مهندسی بافت با کاربرد علم به زبان ساده نیز در دو بخش برنامه آموزشی و کارگاههای عملی ارائه دهد و در راستای تشویق هر چه بیشتر دانشآموزان جهت حضور فعال در مدرسه تابستانی، یک مسابقه اختصاصی درخصوص مطالب ارائه شده در پایان برنامه برگزار خواهد شد و به کاملترین پاسخ، جوایزی نفیس تعلق خواهد گرفت.
دانش-آموزان-آلاء
romisa z Gheibi Kosar A003 @Narjes-Hashemi
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
سلولهایی که مانند آب، انعطافپذیرند و مملو از قابلیتهای ناشناخته و اسرارآمیز؛ این توانایی را دارند که به هر سلولی تمایز بیابند و کارایی خاصی پیدا کنند. از این رو است که با پیشرفت دانش و فناوری، قدر و اهمیت این سلولها در درمان بیماریهای ناشناخته و لاعلاج، بسیار پررنگ شده است.
نقش اثربخش سلولهای بنیادی در درمان
این فناوری به مدد پژوهشهای کاربردی و مرز دانش بسیاری توسعه یافته و امیدها را دست یافتن به دستاوردهایی که تا پیش از این تحقیقشان ناممکن به نظر میرسید قوت داده است. به طور مثال نگاه پژوهشگران و متخصصان به این کاربرد حوزه از درمان، احیای سلولها و کارهای آزمایشگاهی، فراتر رفته و ساخت اندامهای حیاتی بدن به کمک سلولهای بنیادی بیش از گذشته به واقعیت نزدیک شده است.
بیماریهای مختلف، ممکن است به بافتها و اندامهای بدن آسیبهای جبرانناپذیری برسانند که ادامه حیات بیمار را تنها با جایگزین کردن اندام حیاتی از کار افتاده با نوع سالم آن ممکن کند. با توجه به رشد فزاینده جمعیت و ابتلا به بیماریهای اینچنینی، نیاز به پیوند اعضا به طور فزایندهای افزایش یافته است، اما اندام موجود برای پیوند در حال حاضر بسیار کمتر از تقاضا است و این امکان وجود دارد که تقاضا در آیندهای نزدیک نیز افزایش یابد.
به همین دلیل، یکی از دغدغههای مهم در حوزه سلامت امکان ساخت اعضای بدن یا بررسی امکان این موضوع است که چگونه ممکن است عملکرد اعضای بدن در آینده با یک اندام یا روش دیگر جایگزین شود.
فناوریها و روشهای نوآورانه بسیاری وجود دارد که به طور بالقوه ممکن است به یافتن جایگزینی برای عملکرد اعضای بدن کارآمد باشند. با توسعه پژوهشها و افزایش استفاده از فناوری های جدید، اکنون میشود به یک راه و روش تازه برای کمک به بیماران، جدیتر فکر کرد.
نیاز فزاینده به اعضای جایگزین؛
آینده جایگزینی اعضای بدن توسط سه متغیر تعیین خواهد شد. اولین متغیر «نیاز» است ، به ویژه اینکه تعداد ساخت اندامهای جایگزین شده با گذشت زمان تغییر می کند، متغیر دوم راهبردها و فناوریهای جدیدی است که برای جایگزینی آن اندامها در دسترس خواهد بود. متغیر سوم مجموعه ای از موانع زیست شناختی و اجتماعی است که ممکن است مانع جایگزینی عملکرد اندام شود.
نیاز به جایگزینی اعضا ممکن است در سالهای پیش رو به شدت تغییر کند. درمانهای جدید برای بیماری ها، تغذیه بهتر و رویکردهای نوآورانه و فناورانه برای توسعه و رونق بهداشت عمومی از شیوع برخی از بیماریها که باعث نارسایی عضو میشوند جلوگیری کرده و بنابراین نیاز به پیوند را کاهش میدهد.
در هر حال، افزایش طول عمر ناشی از ارتقای فناوریها و روشهای نوآورانه مراقبتهای پزشکی، تغذیه و بهداشت عمومی ، بخش عمده ای از مردم را از بیماریها مانند دیابت و نارسایی قلب یا کلیه مصون خواهد داشت.
توسعه فناوریها و امید به تولید اندامها بافتهای جایگزین
پیشرفت در زیستفناوری، سلولهای بنیادی و پژوهشها در حوزه مولکولی، پروتئومیکس و سایر زمینه ها ممکن است تشخیص بیماری های کشنده را مدتها پیش از ظهور علائم بالینی امکان پذیر کند. یک نمونه خون ممکن است وجود سرطان در کلیه یا ریه را قبل از بروز ضایعه نشان دهد. این تحول پزشک و بیمار را هدایت می کند تا اندامهایی که بالقوه محل بروز سرطان هستند با اندامهای سالم جایگزین و از مرگ بیمار جلوگیری کند.
توسعه دانش و فناوری پیوند پیشگیرانه میتواند تقاضا را برای اعضای جایگزین، به طرز چشمگیری گسترش دهد و همانطور که مفهوم جایگزینی مناسب را تغییر می دهد به طور چشمگیری تغییر می کند.نیاز فزاینده به پیوند این پرسش را ایجاد می کند که کدام فناوری های جدید می توانند برای رفع این نیاز کارآمدتر و جذاب تر باشند. پیوند از افراد زنده در حال حاضر پاسخگوی تقاضای جایگزینی قلب، ریهها، کلیهها و کبد نیست. شاید بتوان با افزایش پیوند اعضا از اجساد، در دسترس بودن به برخی از اندام ها را بهبود بخشید. اما با این وجود پیوند به روش مرسوم باز هم نمیتواند نیاز فزاینده به پیوند اعضا را پاسخ دهد. بر همین اساس فناوریهای نوظهور مانند کاشت دستگاهها و تجهیزات جایگزین، سلولهای بنیادی، مهندسی بافت، ارگانوژنز و پیوند بیگانه مورد توجه قرار گرفته است.
دستگاههایی که به طور کامل قابل کاشت هستند، چند سالی است که به عنوان جایگزینی برای جبران عملکرد برخی از اعضای بدن مورد استفاده قرار میگیرند و حتی به صورت آزمایشی برای جایگزینی عملکرد قلب در دسترس قرار گرفتهاند. دستگاه ها فقط در شرایط حاد استفاده می شوند و استفاده از آنها عوارض و آسیبهای قابل توجهی ایجاد میکند.
با این حال، فناوری این حوزه از ظرفیت توسعه برخوردار است و میتوان تصور کرد که ممکن است روزی به عنوان دستگاههای جایگزین عملکرد قلب مورد استفاده قرار بگیرد. البته در دیگر حوزهها نمیتوان چنین امیدواری داشت، اگرچه تجهیزات و روشهای تهاجمی مانند دیالیز میتوانند عملکرد ریهها و کلیه ها را جایگزین کنند، اما استفاده مستمر از این دستگاهها و روشها، عوارضی جدی مانند عفونت و زخم را به دنبال دارد.توانمندی سلولها در جایگزینی بافتها و اندامها
از آنجاکه سلولهای بنیادی توانایی تکثیر و تمایز به سلولهای نسبتاً بالغ از انواع مختلف را دارند، میتوانند به عنوان روشی کارآمد و اثربخش برای توسعه بافتها و اندامهای جایگزین، مورد توجه قرار بگیرند.
سلول های بنیادی جنینی می توانند به هر عضوی در بدن تبدیل شوند و وقتی در بلاستوسیست قرار می گیرند این کار را میکنند. این دسته از سلولهای بنیادی میتوانند برای جایگزینی هر عضوی در بدن استفاده شوند. با این حال ، حداقل دو عامل این احتمال را محدود می کند. نخست اینکه سلولهای بنیادی جنینی یک فرد، از نظر ژنتیکی به طور اجتناب ناپذیری با فرد تحت درمان متفاوت است و استفاده از بافت ها یا اندام های حاصل از این سلولها ممکن است به سرکوب سیستم ایمنی نیاز داشته باشد.
محدودیت در استفاده از سلولهای بنیادی جنینی یا سلولهای بنیادی تولید شده توسط شبیهسازی هستهای این است که در حالی که می توان آن سلول ها را به سلول ها و بافت های متمایز تبدیل کرد، اما مشخص نیست که به وسیله چه سلول هایی میتوان اعضا را خارج از جنین و به چه شکلی تولید کرد. اما این روش فناورانه، به کمک سلولهای بنیادی امیدها را برای ساخت و توسعه بافت و اندامهای جایگزین تفویت میکند.
فناوری دیگری که بعضاً برای جایگزینی اعضای بدن پیشنهاد می شود، ارگانوژنز است. ارگانوژنز به رشد اندامهای دست نخورده یا بافتهای شبیه اندام از سلولهای بنیادی اشاره دارد. همانطور که ارگانوژنز به طور طبیعی در جنین اتفاق می افتد، همچنین میتواند زمانی رخ دهد که بافت ها یا سلول های عضوی از جنین اولیه در بافت میزبان قرار گرفته یا در حیوانات زنده کاشته شوند.
به عنوان مثال، بافتهای کلیوی رشدیافته در جنین می توانند در شرایط آزمایشگاهی گلومرول بالغ و اندام هایی در پستانداران بالغ تولید کنند.
از بافت ها و سلول های جنین می توان برای تولید بافتهای مهندسی شده نیز استفاده کرد. استفاده از ارگانوژنز توسط منبع و ایمنی زایی بافتهای جنین محدود می شود. بافت جنین انسان برای این منظور مناسب نیست. برخی پیشنهاد کرده اند که به جای آن از بافتهای جنینی حیوانات استفاده شود. با این حال ، این روش نیز به عنوان راهکاری برای توسعه فناوری بافت و اندامهای جایگزین در دست مطالعه و توسعه است.
در صورت بررسی دقیق و تجزیه روشها و فناوریهای گوناگون، به طوری که از مزایای هر فناوری بهره برده شود، می توان موانع جایگزینی اندام را برطرف کرد.
با استفاده از هریک از این فناوریهای از تولید سلولهای بنیادی و استفاده از سلولهای بنیادی بدست آمده در یک مکان مناسب در یک جنین زنوژن دستاوردهای خوبی حاصل شده است.
به طور مثال، مطالعههای اخیر سلولهای بنیادی انسانی وارد شده به خوک جنین می توانند به روش های طبیعی و هیستوتیپی در مکان های مناسب در جنین خوک بالغ شوند. بافت هایی که در این سیستم ژنوژنیک شروع به بلوغ می کنند ممکن است برداشت شوند و سلولهای متمایزشده به فرد منتقل می شوند تا بلوغ و تمایز کامل رخ دهد.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
دانشمندان یک ماده بیولوژیکی جدید ایجاد کرده اند که رگ های خونی و استخوان را دوباره رشد می دهد و یک روش تک مرحله ای هنگام ترمیم نقص در استخوان های بلند را ارائه می دهد.
این مطالعه توسط محققان RCSI و مرکز SFI AMBER انجام شده و در ژورنال Controlled Release چاپ شده است.
تحقیقات قبلی محققان RCSI نشان داده بود که فعال سازی ژن حساس به مکانیسم، به نام فاکتور رشد جفت (PGF) ، در دوزهای مختلف باعث بازسازی استخوان و رشد رگ های خونی جدید می شود. با استفاده از این دانش، محققان یک ماده زیستی تولید کردند که PGF را در غلظت های مختلف ارائه می دهد.
با الهام از روش طبیعی بازسازی نقص استخوان ، ماده اولیه ابتدا دوز بالایی از PGF آزاد می کند و رشد رگهای خونی را تقویت می کند و به دنبال آن با دوز پایدار پایین تری از آن باعث بازسازی استخوان می شود. هنگامی که این ماده در یک مدل پیش بالینی آزمایش شد، ماده بیولوژیکی با موفقیت نقایص استخوان بلند را ترمیم کرده و در عین حال عروق خونی را رشد داد.
مواد زیستی موجود که هم رگ های خونی و هم رشد استخوان را تقویت می کنند، معمولاً به استفاده از بیش از یک داروی درمانی نیاز دارند. علاوه بر این، داروهایی که برای استفاده در کلینیک تأیید شده اند با عوارض جانبی خطرناکی همراه بوده و نیاز به استراتژی های جدید را برجسته می کنند.
پروفسور فرگال اوبراین، محقق اصلی تحقیق و مدیر تحقیق و توسعه ی RCSI گفت: "قبل از شروع آزمایشات بالینی، آزمایشات بیشتری لازم است و در صورت موفقیت، این ماده بیولوژیکی می تواند هنگام ترمیم نقایص استخوانی برای بیماران بسیار مفید باشد."
https://medicalxpress.com/news/2021-04-biomaterial-regrows-blood-vessels-bone.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
زیست شناسان از سلول های بنیادی پرتوان انسان برای رشد مدل های قلب کوچک، به نام "کاردیوئید" استفاده کرده اند که خود به خود و بدون نیاز به داربست، به صورت یک محفظه ی توخالی سازماندهی می شوند. این دستاورد، امکان ایجاد واقعی ترین ارگانوئیدهای قلب تا به امروز را فراهم کرده است.
پیش از این، دانشمندان از طریق مهندسی بافت، ارگانوئیدهای قلبی سه بعدی با رویکردی که شامل مونتاژ سلول ها و داربست هاست را ساخته اند. اما این ارگانوئیدهای مهندسی شده پاسخ فیزیولوژیکی مشابه به قلب انسان نسبت به آسیبها نداشته اند و بنابراین اغلب نمی توانند به عنوان مدل خوبی برای بیماری ها عمل کنند.
این تیم تحقیقاتی می خواستند تکوین قلب به صورت خود- سازماندهی شده را در ظرف کشت تقلید کنند. آنها با فعال کردن هر شش مسیر سیگنالینگ شناخته شده در رشد قلب جنینی باعث خود-سازماندهی سلولهای بنیادی شدند. با تمایز سلول ها، شروع به تشکیل لایه های جداگانه، شبیه به ساختار دیواره قلب کردند. بعد از یک هفته، این ارگانوئیدها به صورت خود به خودی به یک ساختار سه بعدی که دارای حفره ای محصور است (یعنی یک مسیر رشد خود به خودی مانند قلب انسان) سازمان داده شدند. علاوه بر این، این تیم متوجه شد که بافت دیواره مانند کاردیوئید به طور ریتمیک منقبض می شود تا مایع اطراف حفره را فشار دهد.
همچنین این تیم نحوه ی واکنش کاردیوئیدها به آسیب های بافتی را نیز آزمایش کردند. آنها از یک میله فولاد سرد برای یخ زدن بخشهایی از این قلب کوچک استفاده کرده و سلولهای زیادی را در محل از بین بردند. محققان مشاهده کردند که مشابه آنچه معمولا پس از آسیب هایی مانند حمله قلبی مشاهده می شود، مرگ سلولی اتفاق افتاد و بلافاصله پس از آسیب، فیبروبلاست های قلبی - نوعی سلول مسئول ترمیم زخم - شروع به مهاجرت به سمت نقاط آسیب دیده و تولید پروتئین برای ترمیم آسیب کردند.
این تیم قصد دارد ارگانوئیدهای قلبی با چندین محفظه مانند آنچه در قلب واقعی انسان دیده می شود را ایجاد کند. بسیاری از بیماری های مادرزادی قلب هنگامی اتفاق می افتند که سایر محفظه ها شروع به تشکیل می شوند، بنابراین مدل چند محفظه ای به پزشکان کمک می کند تا درک بهتری از شکل گیری نقص در جنین داشته باشند.
https://www.sciencedaily.com/releases/2021/05/210520133927.htm
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
یک مطالعه تحقیقاتی در Ludwig Cancer Research کشف کرده است که چگونه می توان یک زیر مجموعه قدرتمند اما بی عملکرد سلولهای ایمنی ضد سرطان که اغلب در تومورها یافت می شود را برای درمان سرطان احیا کرد.
این تحقیق با هدایت پینگ چیه هو و لی تانگ از Ludwig Lausanne از École Polytechnique Fédérale de Lozan انجام شده است. این مطالعه توصیف می کند که چگونه یک فاکتور ایمنی معروف به اینترلوکین -10 عملکرد لنفوسیت های T نفوذپذیر تومور "خسته" (TILs) را که تا کنون ثابت شده است در برابر تحریکات ایمنی درمانی غیرقابل نفوذ است را احیا می کند. همچنین نشان می دهد هنگامی که این فاکتور همراه با روشهای درمانی سلول استفاده شود، می تواند تومورهای ملانوم و سرطان روده بزرگ را در مدلهای موش از بین ببرد. یافته های این مطالعه در شماره ی فعلی Nature Immunology گزارش شده است.
https://medicalxpress.com/news/2021-05-revive-potent-immune-cells-cancer.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
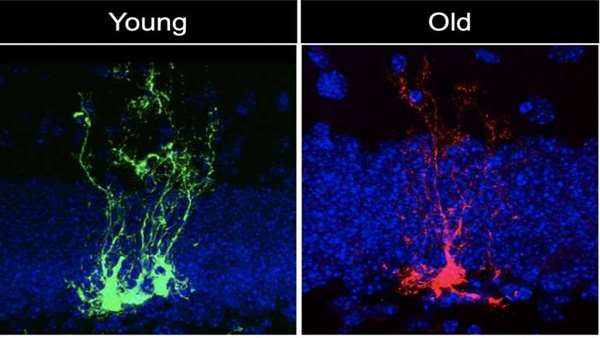
در مطالعه جدید منتشر شده درCell Stem Cell، تیمی به سرپرستی دانشمند سلولهای بنیادی USC، مایکل بوناگوئیدی، نشان داد که سلولهای بنیادی عصبی - سلولهای بنیادی سیستم عصبی - به سرعت پیر می شوند.
بوناگوئیدی، استادیار زیست شناسی سلول های بنیادی و پزشکی بازساختی و مهندسی پزشکی در دانشکده پزشکی Keck از USC گفت: "دو نوع پیری زمانی و پیری بیولوژیکی وجود دارد که این دو مثل هم نیستند." "ما در مورد پیری بیولوژیکی سلولهای بنیادی عصبی که به ویژه در معرض آسیب های زمانی نیز هستند، تحقیق می کنیم. بیشتر ما با پیرتر شدن و همچنین زوال عقل، بیماری آلزایمر، صرع و آسیب مغزی را تجربه می کنیم. "
در این مطالعه، اولین نویسنده آلبینا ابرایوا که برای بررسی مغز موش های جوان، میانسال و پیر به همکاران خود پیوست. آنها با ردیابی سلولهای بنیادی عصبی یا NSC ، طی چند ماه ، "NSC کوتاه مدت" را شناسایی کردند که به سرعت به سلولهای عصبی تمایز می یابد و همچنین "NSC طولانی مدت" شناسایی شد که به طور مداوم تقسیم و تکثیر می یابد تا یک جریان مداوم جهت ذخیره سلولهای بنیادی با توانایی تولید انواع مختلف سلول در مغز را حفظ کند. این جمعیت کلیدی" NSC های طولانی مدت " کمتر تقسیم می شوند و با پیر شدن موش ها قادر به حفظ تعداد خود نیستند.
در ادامه، دانشمندان هزاران ژن در" NSC طولانی مدت" را بررسی کردند که کمتر تقسیم می شوند و به حالت سکون فرو می روند. فعالیت ژنی NSC های ساکن در حیوانات جوان و میانسال بسیار متفاوت است. همانطور که انتظار می رفت، تغییراتی در ژن هایی ایجاد شد که نحوه تقسیم" NSC طولانی مدت" را کنترل کرده و همچنین سلول های عصبی جدید و سلول های دیگر مغز را تولید می کنند. نکته قابل توجه اینست که تغییرات مهمی در فعالیت ژن مربوط به پیری بیولوژیکی در سنین پایین نسبت به آنچه پیش بینی شده بود، وجود داشت. این ژن های پیشبرنده ی پیری، کار سلول ها را در ترمیم آسیب DNA، تنظیم فعالیت ژنتیکی، کنترل التهاب و کنترل سایر استرس ها دشوارتر می کند.
دانشمندان در میان ژن های پیشبرنده ی پیری، بیشتر شیفته ی ژن Abl1 شدند که مرکز شبکه ای از ژن های بهم پیوسته را تشکیل می دهد.
ابرایوا گفت: "ما به ژن Abl1 علاقه مند بودیم، زیرا هیچ کس تا به حال نقش آن را در زیست شناسی سلول های بنیادی عصبی - چه در حال رشد و چه در پیری مطالعه نکرده است. "
دانشمندان می توانند با استفاده از داروی شیمی درمانی مورد تأیید FDA به نام Imatinib، به راحتی فعالیت ژن Abl1 را مهار کنند. دانشمندان به مدت شش روز به موش های مسن تر دوز Imatinib دادند. پس از آنکه دارو فعالیت ژن Abl1 را مسدود کرد، NSC ها در هیپوکامپ که بخشی از مغز که مسئول یادگیری و حافظه است، شروع به تقسیم بیشتر و تکثیر کردند.
بوناگوئیدی گفت: "ما موفق شده ایم که باعث تقسیم بیشتر سلول های بنیادی عصبی بدون تخلیه شدن شویم و این مرحله اول است." "مرحله دوم القا این سلولهای بنیادی برای ساختن سلولهای عصبی بیشتر خواهد بود. در مرحله سوم نشان می دهیم که این سلولهای عصبی اضافی در واقع یادگیری و حافظه را بهبود می بخشد. کارهای زیادی باقی مانده است که باید انجام شود، اما این مطالعه پیشرفت هیجان انگیزی را در جهت هدف ما از شناسایی داروهایی که می توانند با افزایش سن، مغز ما را جوان کنند، نشان می دهد. "
https://medicalxpress.com/news/2021-04-reveals-neural-stem-cells-age.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470








 🧫
🧫