زیرلایه ...
-
سلام بچه ها چرا با اینکه لایه سوم 18 e ظرفیت داره ولی پس از 8e وارد دوره 4 میشیم ، یکم مباحث رو قاطی کردم
-
سلام بچه ها چرا با اینکه لایه سوم 18 e ظرفیت داره ولی پس از 8e وارد دوره 4 میشیم ، یکم مباحث رو قاطی کردم
Reza Dolatsha سلام بخاطر سطح انرژی زیر لایه هاست در واقع همون قانون آفبا.
-
سلام بچه ها چرا با اینکه لایه سوم 18 e ظرفیت داره ولی پس از 8e وارد دوره 4 میشیم ، یکم مباحث رو قاطی کردم
Reza Dolatsha
سلام
بدلیل سطح انرژی زیر لایه هاست که باید اول زیرلایه با سطح انرژی پائین تر پر بشه بعد از اون به ترتیب بالا میرن. -
Reza Dolatsha
سلام
بدلیل سطح انرژی زیر لایه هاست که باید اول زیرلایه با سطح انرژی پائین تر پر بشه بعد از اون به ترتیب بالا میرن.@Mr-Perfect

داداش در این قسمت ها فقط یک الکترون وارد زیر لایه s میشه؟ -
سلام بچه ها چرا با اینکه لایه سوم 18 e ظرفیت داره ولی پس از 8e وارد دوره 4 میشیم ، یکم مباحث رو قاطی کردم
Reza Dolatsha سطح انرژی
اگه راه ابریشم شیمی رو داری حتما ببین خیلی کامل این مبحث که من دیدم تا الان توضیح میده -
@Mr-Perfect

داداش در این قسمت ها فقط یک الکترون وارد زیر لایه s میشه؟Reza Dolatsha
بله یک الکترون وارد میشه ولی بحث اون متفاوت هست علتش این هست که d4 و d9 ناپایدار هست و برای پایدار شدن تبدیل میشن به d5 (نیمه پر) و d۱۰(پر) که اون موقع این یک الکترون که وارد d شده از s کم میشه. -
سلام بچه ها چرا با اینکه لایه سوم 18 e ظرفیت داره ولی پس از 8e وارد دوره 4 میشیم ، یکم مباحث رو قاطی کردم
سلام با توجه به قاعده افبا الکترون ها زیر لایه ها رو پر می کنند
همون طور که داخل کتاب اومدهn+L هر زیر لایه که کمتر باشه الکترون وارد اون میشه
و اگر n+L دو تا زیر لایه برابر شده الویت با اون زیر لایه ای هست کهn ش. کمتر.البته این قاعده استثنا هایم داره مثل cr و cu
از دستهdبه همین دلیل هم همه الکترون های لایه ها هم زمان به ترتیب پر نمی شند الویت با قاعده افبا هست و هر وقت نوبتشون بشه و عددشون از زیر لایه های باقی مانده کمتر باشه پر می شند.

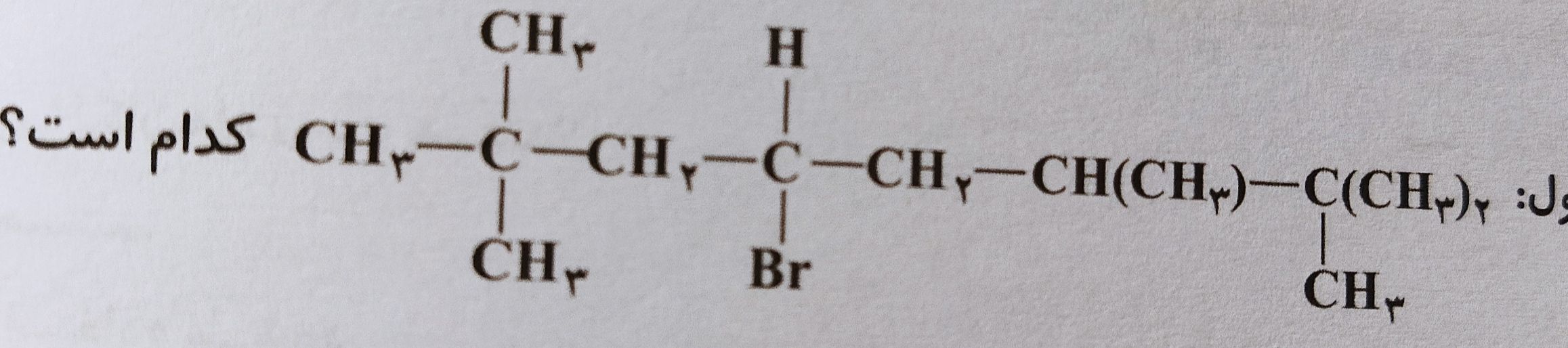

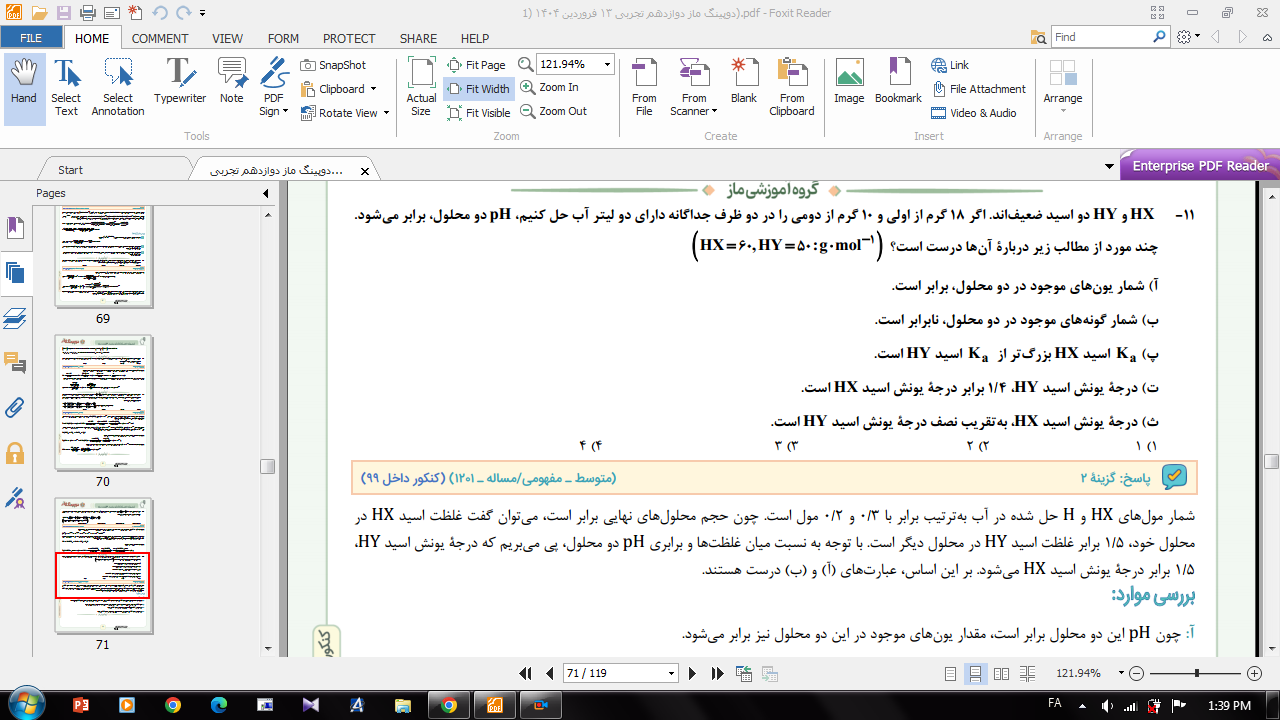
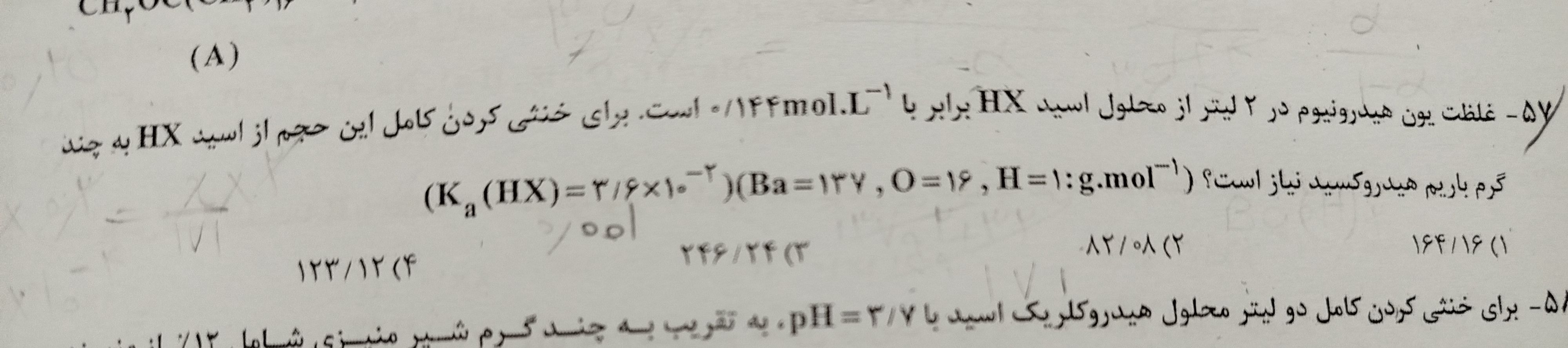
 روش دیدن فیلم آموزشی کلاس های سالیانه و روش مطالعه ی شیمی 🧪
روش دیدن فیلم آموزشی کلاس های سالیانه و روش مطالعه ی شیمی 🧪
