سلام سلاااام🤩
بچه ها تو این تاپیک میخوایم دانشجوها هم مثل کنکوریا ساعت مطالعه شون رو اعلام کنن ✌
هم انگیزه بشه برای فارغ التحصیلای آلاء تا تو محیط دانشگاه هم دست از تلاشِ آلائی برندارن 💪و هم اینکه کنکوریای با درسایی که دانشجوها میخونن یکم آشنا میشن🤗
پس از امشب استارت این تاپیک رو میزنیم و هرشب میایم و میگیم در طول روز چ درسایی رو خوندیم ،چند ساعت و چیکارا کردیم😁
دعوت میکنم از @فارغ-التحصیلان-آلاء که باهامون همراه بشن🤝
خیلی ممنون از z Gheibi و M.ba78 بابت پیشنهاد و همراهیشون❤
راستی از romisa جانم هم دعوت میکنم بهمون سر بزنه و همراهیمون کنه😍
سلام به بچه های عزیز آلا🌻
خب دوستان تو این تاپیک قراره که تجربه هامون رو از دانشجویی بگیم
نحوه درس خوندن، نحوه ارتباطات،خوابگاه و... هر صحبتی که تو ذهن تون هست
که ورودی های امسال مون بتونن استفاده کنن😊
ممکنه حتی یه سری نکات و صحبت ها بگیم که خودمون هم ندونیم و بهمون کمک بشه😅
و اینکه بچه های جدید حتما سوالات شون رو بپرسن
@فارغ-التحصیلان-آلاء @رتبه-های-انجمن-آلاء
@تجربیا @ریاضیا @انسانیا
@بچه-های-تجربی-کنکور-1402
@بچه-های-ریاضی-کنکور-1402
@همیار
سلام.
تا حالا فک کردین به یه سیستم عامل دیگه مهاجرت کنین؟ گاهی اوقات حس نکردین از ویندوز خسته شدین؟
خب من درمانش رو دارم بیاین لینوکس بریزیم، همه!
اصلا لینوکس چیه؟
خب اینه: "لینوکس (Linux) یک سیستم عامل رایگان و متن باز است که بر پایه هسته Linux (کرنل) توسعه داده شده است. هسته لینوکس مسئولیت مدیریت منابع سختافزاری و ارتباط بین نرمافزار و سختافزار در سیستم را بر عهده دارد."
متن بازی (open source ) یعنی چی؟ یعنی کد هاش برای همه آزاد و همه می تونن بیاین لینوکس رو تغییر بدن، (گویی انگولش کنن) اما ویندوز این شکل نیست کدهای توسعه ویندوز، رو فقط خود مایکروسافت داره. (واسه همین ویندوز گرونه 199 دلار ویندوز 11 پرو 😲 )
خلاصه اش اقا اینکه لینوکس یه هسته ی اصلی داره حالا می رسیم به توزیع های لینوکس.
اینم تاریخچه ش :در سال 1991 فردی با نام لینوس توروالدز (Linus Torvalds)، دانشجوی رشته علوم کامپیوتر در دانشگاه هلسینکی فنلاند، تصمیم گرفت یک سیستم عامل جدید بر اساس یونیکس (Unix) طراحی کند. او نیازمند یک سیستم عامل برای استفاده شخصی و توسعه برنامههای خود بود. لینوس کد منبع سیستم عامل خود را در اینترنت منتشر کرد و خواستار کمک و بازخورد از جامعه برنامهنویسی شد. این کد با عنوان “هسته لینوکس” شناخته میشد.
گروهی از برنامهنویسان از سراسر جهان به لینوس پیوستند و شروع به توسعه و بهبود هسته لینوکس کردند. این جامعه برنامهنویسی فعال با همکاری بینالمللی سایر برنامه نویسان باعث شد هسته لینوکس به سرعت رشد کند. در سال 1994، نسخه اولیه رسمی Linux با ورژن 1.0 منتشر شد. این نسخه اولیه شامل امکانات اساسی سیستم عامل شبیه به یونیکس بود و از آن پس، توسعه و بهبودهای بیشتری در هسته لینوکس صورت گرفت.
(اینجاش مهمه)
با گذر زمان، جامعه برنامهنویسی Linux رشد کرد و شرکتها و سازمانها نیز به توسعه و پیشرفت لینوکس کمک کردند. این شرکتها شامل ردهت (RedHat)، اینتل (Intel)، آیبیام (IBM) و بسیاری دیگر بودند. به مرور و با گذشت زمان، Linux به عنوان یک سیستم عامل پرکاربرد، به ویژه در سرورها و دستگاههای همراه، شناخته شد. همچنین، توزیعهای لینوکس محبوبی مانند اوبونتو (Ubuntu)، فدورا (Fedora) و دبیان (Debian) با امکانات و رابط کاربری متنوعی ارائه شدند.
از آن زمان تا به امروز، Linux به یکی از قدرتمندترین و پرطرفدارترین سیستم عاملها تبدیل شده است و در بسیاری از زمینهها از توزیع های مختلف Linux استفاده میشود، از جمله سرورها، دستگاههای هوشمند و رایانههای شخصی.
اگه به میخواین در آینده مهندسی نرم افزار، کامپیوتر، ای تی، شبکه و هزاران چیز دیگه مربوط به علوم کامپیوتر و کامپیوتر بخونین پیشنهاد می کنم همین الان لینوکس رو نصب کنید.
حالا چه توزیعی بریزیم؟
من نزدیک 1.5 ساله از ویندوز مهاجرت کردم به لینوکس و تاحالا سه تا توزیع مختلف روی ماشین مجازی ریختم و تست کردم. عملا انچنان تفاوت خاصی با هم ندارند ولی
برای شروع پیشنهاد می کنم (یعنی خیلی نوبی) : اوبونتو (ubuntu) یا linux mint یا manjaro ، این توزیع های خوبن
من در حال حاضر از manjaro استفاده می کنم که واقعا توزیع مناسبیه، ولی اگه اصلا لینوکس کار نکردین ubuntu یا linux mint بریزین.
حالا چجوری لینوکس بریزیم؟
مثلا برای نصب ubuntu میرم تو گل سرچ می کنیم download ubuntu و وبسایت رسمی ubuntu نسخه اخرین نسخه LTS اوبنتو رو بریزین ( در حال حاضر اخرین نسخه Ubuntu 24.04.1 LTS) هستش
[LTS یعنی چه مخفف long-term support یعنی ما معنی پنج سال به روز رسانی رایگان امنیتی میدیم که یعنی توزیع پایدار و با ثباتی واسه همین برای تازه کارا مناسبه]
یه فایلی به پسوند iso. دانلود میشه.
با نرم افزار refus این فایل رو روی یه فلش یا سی دی بوت می کنیم ( آموزش هاش داخل آقای گوگل هست و می تونین سی دی اوبونتو رو بخرید که بوت شده)
فلش رو وصل می کنیم، سیستم یه ریستارت می زنیم بعد قبل اینکه سیستم بالا بیاد یکی از دکه های f12 یا f10 یا del یا ... ( با توجه به نوع مادربرد، لپتاپ و ... احتمال 99 درصد f12 هستش) از منو بوت فلش رو انتخاب می کنیم و تامام وارد پنجره نصب اوبونتو میشیم که به شدت ساده هستش، داخل اینترنت میلیون ها آموزش نصب اوبنتو و بقیه توزیع ها هستش)
▶️| #معرفی_رشته
بریم برای یه معرفی رشته ی جداب
#مهندسی_پزشکی
☁️رشته ی مهندسی پزشکی چیه؟
ساخت تجهیزات پزشکی یکی از کارهایی هست که بچه های این رشته انجام میدن
این علم تلاش می کنه تا مهندسین پزشکی بتونن از ایده های پزشکی استفاده کنن
🌥کسی که این رشته رو خونده باید چه ویژگی هایی داشته باشه؟
خلاقیت و نو اوری داشته باشه
مسلط به زبان انگلیسی باشه
نرم افزار های تخصصی طراحی رو بلد باشه
قادر به تحلیل نیاز های مشتریان و بیماران باشه
ریاضی، فیزیک، زیست و شیمی اش قوی باشه
⛅️ تهش چی میشه؟
کار در شرکت های تخصصی تجهیزات پزشکی
کار در شرکت های دانش بنیان در حوزه ی مهندسی پزشکی
نمایندگی فروش و خدمات پس از فروش تجهیزات پزشکی وارداتی
طراحی و ساخت دستگاه های تشخیص مشکلات پزشکی و بیماری ها
کار و تحقیق در جنبه های فنی و مهندسی مربوط به سیستم های بیولوژیکی انسان ها و حیوانات
نصب، تنظیم و نگهداری، تعمیر یا پشتیبانی فنی تجهیزات پزشکی با عنوان متخصص تجهیزات پزشکی بیمارستانی
🌤 مسیر تحصیلی اش چیه؟
کارشناسی: مهندسی پزشکی
کارشناسی ارشد: بیوالکتریک، بیومکانیک، بیومتریال
دکتری: مهندسی بافت، رباتیک پزشکی، پردازش سیگنال ها با تصاویر پزشکی، ابزار دقیق پزشکی، مهندسی ورزش، بیوالکتریک، بیومکانیک، بیومتریال
منبع یک کاناله امیدوارم اطلاعات درست باشند. باز هم خودتون بررسی کنید
@ida-shateri
@بچه-های-کنکور-ریاضی-1400
@ریاضیا
سلام
امیدوارم حالتون خوب باشه
یلدای گذشته مبارکتون 🙂❄️🌸
یه سوال داشتم از دانشجو های آلایی
روش خاصی برای جزوه نویسی دارین ؟
اون دسته دروسی که علاوه بر فایل ، صحبتای استاد هم مهمن رو چیکار میکنین ؟
من خودم نکات اضافه ی گفته شده سر کلاس و فایل خود استاد ( در صورتی که استاد فایلشو بده 🙄 ) رو با هم تو جزوه پاک نویس میکنم ولی خب آخر ترم با حجم بالای نکات چرکنویس و فایلای نوشته نشده روبرو میشم😐💔
و از طرفی خوندن و تسلط روی مطالب نسبت به جزوه نویسی مهم تره ، مخصوصا الان که نزدیک به امتحانات ترم هستیم
ممنون میشم تجربیاتتون در این زمینه رو به اشتراک بذارین 🙏🌸
شاید یکی از نقاط عطف زندگیتون در دوران دانشجویی،فارغ از اینک چی میخونید یادگیری زبان برنامه نویسی اندروید،با توانایی ساخت اپلکیشن،میتونید هم به درآمدی برسید هم مشکلات زیادی رو که پیش میاد واستون رفع کنید...پیشنهاد من این از بیسیک فور اندروید شروع کنید(b4a),ساده ،روان ،قوی
کل چیزی که نیاز دارید؛
۱)ی سیستم ساده کامپوتری
۲)ی گوشی
۳) سه ماه وقت گذاشتن و تمرین
هر سوالی هم در این زمینه داشتید میتونید اینجا بپرسید،از مراحل نصب و ساخت تا انتشار در مارکت ها..
سلول های بنیادی راهی به آینده
-
پژوهشگران پیش از این مولکولی به نام JNK3 را کشف کرده بودند که یک عامل کلیدی برای افزایش حساسیت سلول های بنیادی کودکان به محیط شان و بازسازی بهترشان در مقایسه با بالغین بود. این کشف تا حدی توضیح می دهد که چرا کودکان ترمیم استخوان سریع تری در مقایسه با بزرگسالان دارند. بر مبنای این یافته آن ها بیوماده جدیدی را تولید کردند که ساختار بافت استخوانی را تقلید می کند و حاوی نانوذراتی است که JNK3 را فعال می کند.
تست این زیست ماده روی مدل های پیش بالینی نشان داد که این زیست ماده می تواند یک ماه بعد از استفاده نواقص استخوانی بزرگ را سریع تر درمان کند و التهاب را کاهش دهد. این زیست ماده جدید در مقایسه با زیست مواد بارگیری شده با داروها به طور بی خطرتر و موثرتری استخوان را ترمیم می کند و عوارض جانبی مربوط به آن ها را نیز ندارد.
Reference:https://www.sciencedirect.com/science/article/pii/S0142961220307869?via%3Dihub
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
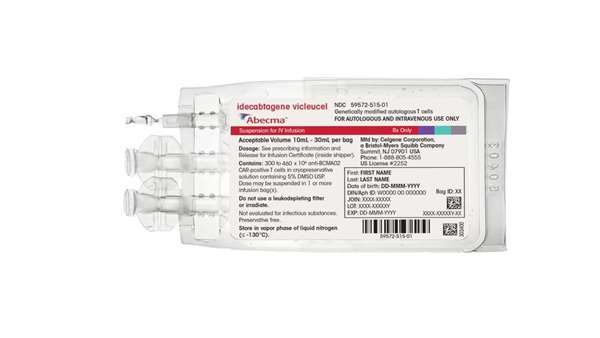
ژندرمانی مبتنی بر سلول Abecma (idecabtagene vicleucel) شرکت سلژن کورپوریشن (زیرمجموعه شرکت بریستول میرز اسکوییب) برای درمان بیماران بزرگسال مبتلا به ملتیپل مایلوما که بیماری آنها به دستکم چهار درمان مختلف پاسخ نداده یا بیماری آنها پس از دریافت این درمانها بازگشته است، تائیدیه سازمان غذا و دارو آمریکا (FDA) را دریافت کرد
ژندرمانی مبتنی بر سلول Abecma نخستین ژندرمانی مبتنی بر سلول تائید شده توسط FDA برای درمان ملتیپل مایلوما است.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
چگونه بیماریهای بدخیم با روشهای نوین درمان میشود؟!
روشهای درمانی پیشرفتهای که مبتنی بر فناوری سلولهای بنیادی است، درمان بیماریهای مهلک و صعبالعلاجی چون سرطان را از پای در میآورند.
نامش هم که برده میشود، لرزه بر اندام میاندازد و نگرانی میآورد. سرطان، که بلای جان جهان شده و در انواع گوناگونی تکثیر یافته، به یکی از مشکلات نظام سلامت در تمامی کشورهای دنیا بدل شده است.
از میان تمامی سرطانها، تومورهای بدخیم مغزی معمولا به درمان پاسخ مناسبی نشان نمی دهند و یا به علت موقعیت خاص قرارگیری در مغز، دارورسانی یا تابش پرتو به آنها با مشکل مواجه می شود. بنابراین، میزان مرگ و میر در مبتلایان به تومورهای بدخیم مغزی بیشتر و درمان آنها با مشکلات بیشتری مواجه است.
استفاده از سلولها علیه سلولها
پیشرفتهای دانشی و فناورانه در سالهای اخیر به ویژه در حوزه سلولهای بنیادی، موجب شده است تا درمان بیماران سرطانی نیز ابعادی تازه را تجربه کند.
استفاده از سلول های ایمنی برای درمان تومورهای مغزی بارقههای امید به درمان را در این بیماران و سایر مبتلایان به سرطان افزایش دهد. این کار توسط دانشگاهها و شرکتهای دانشبنیان داخلی آغاز شد و فناوری جداسازی و فعالسازی سلولهای ایمنی توسط فناوران کشور به دست آمد. با این فناوری، هدفگیری سلول های تومور مغزی در محیط آزمایشگاه و نیز مدل های پیش بالینی ممکن شد.
نتایج پژوهشهای پیش بالینی و بالینی در مراکز پژوهشی و تحقیقاتی کشور از جمله پژوهشگاه رویان برای بیماران مبتلا به تومور مغزی شد. به استحصال موفقیتآمیز سلولهای ایمنی در شرایط کاملا تمیز منجر شد. سلول های کشنده طبیعی از خون دهندگان جداسازی و تقویت می شدند تا بتوانند سلول توموری را هدف گیری کنند. پس از تایید صحت و سلامت سلول ها، سلولها به بیماران تزریق شد و عوارض ناشی از تزریق این سلول ها در بیماران بررسی می شد تا ایمنی این روش درمانی مورد ارزیابی قرار بگیرد.
نتیجه بررسی این نوع درمان بر پنج بیمار مبتلا به تومور مغزی گلیوبلاستوما نشان داد که کاربرد این سلول ها ایمن است و عوارضی برای بیمار ندارد. در حال حاضر پژوهشگاه رویان تحقیق برای استفاده از این سلول ها در هدف گیری سلول های توموری در سرطان تخمدان و ملانوما را در دست اجرا دارد. چنانچه در این زمینه نیز نتایج موفقیت آمیز باشد، انجام کارآزمایی های بالینی برای نوع پیشرفته از سرطان تخمدان و سرطان بدخیم پوستی آغاز خواهد شد.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
در حالی که واکسیناسیون گسترده بهترین راه برای مقابله با پاندمی COVID-19 محسوب می شود اما قطعا نیاز به درمان هایی که بتوانند ویروس را مهار کنند یا بیماری را درمان کنند هیچ گاه منتفی نخواهد شد. این پروتئین یک واریته از ACE2( آنزیم مبدل آنژیوتانسین 2) است که گیرنده ای برای ورود کروناویروس به سلول های انسانی است. این پروتئین سنتزی با پروتئین اسپایک یا S ویروس کرونا برهمکنش می کند و با اتصال به آن مانع از اتصال ویروس به گیرنده ACE2 واقعی در غشای سلولی می شود. این پروتئین در ارگانوئیدهای کلیوی انسانی تست شد و مشاهده شد که بخوبی می تواند به صورت رقابتی مانع از آلودگی سلول های کلیوی به ویروس کرونا شود. گام بعدی مطالعه انجام فازهای بالینی استفاده از این پروتئین برای تایید ایمنی و کارایی آن خواهد بود.
https://medicalxpress.com/news/2021-02-protein-neutralizes-covid-tiny-human.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

دانشمندان دانشکده پزشکی وارویک در دانشگاه وارویک (کاونتری ، انگلستان) کشف کرده اند که کاهش سلول های پیش ساز قطره در پوشش رحم ممکن است منجر به ناتوانی بارداری به صورت مکرر شود. این تحقیق که اخیراً در مجله STEM CELLS منتشر شده است، مدعی است که با مهار این نقصان میتوان مانع از بروز این ناباروریها شد.
در طی یک بارداری معمولی ، پوشش رحم، که به عنوان آندومتر شناخته می شود کاملاً خود را بازسازی میکند. به دنبال این فرآیند ، سلولهای استرومایی آندومتر به سلولهای جداگانه و ویژهای تبدیل میشوند که قابلیت انعطاف پذیری رحم را فراهم و رشد سریع جنین را ممکن میسازد.
لذا برای مقابله با این موضوع، در ابتدا تیم Brosnens گروهی از سلولهای مزانشیمی بسیار تکثیر یافته (hPMC) موجود در پنجره کاشت جنین را شناسایی کردند تا به عنوان هدف درمانی، مورد توجه قرار گیرند.
همچنین نویسنده این مقاله اذعان داشت: "یافته های ما نشان میدهد که hPMC از سلولهای بنیادی مشتق شده از مغز استخوان بوده که به طور متناوب در گردش بوده و در زمان کاشت جنین در پوشش رحم ورود پیدا میکنند. لذا به نظر میرسد این سلولها در حاملگی بسیار مهم هستند تا بتوانند جفتی را که به سرعت در حال رشد است جای دهند. ما همچنین دریافتیم که این سلولهای نادر اما بسیار متخصص در پوشش رحم زنان باردار مکرر وارد می شوند."
بنابراین این نتایج نشان می دهد که hPMC نقش مستقیمی در تشکیل یک ارتباط قوی بین مادر و جنین دارد.
Siobhan Quenby (از دانشگاه وارویک) ، یکی از محققین این پژوهش اینگونه بیان داشت که: "این یافته ها بسیار هیجان انگیز است." "ما قبلاً نشان داده ایم که میتوانیم این سلولهای بسیار تکثیر یافته را در پوشش رحم قبل از بارداری افزایش دهیم. این یافتههای جدید نشان میدهد که چرا این سلولهای بسیار تکثیر یافته برای جلوگیری از سقط جنین و احتمالاً زایمان زودرس (دو اختلال ویرانگر بارداری که بسیاری از زنان و زوجها را در سراسر جهان تحت تأثیر قرار می دهد) میتوانند مهم باشند. "
https://www.regmednet.com/depleting-decidual-precursor-cells-linked-with-pregnancy-loss/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

بیماری Batten به دلیل جهش در ژن CLN3 رخ می دهد که روی کروموزوم 16 قرار دارد. اغلب کودکان مبتلا به این بیماری بخشی از ژن شان از بین رفته است که همین امر مانع از تولید پروتئین های خاص می شود. از دست رفتن بینایی در اوایل چهار سالگی شروع می شود و روی یادگیری و رفتار فرد نیز اثراتی را بر جای می گذارد و آن ها در نهایت بین سنین 15 تا 30 سالگی می میرند.
به خوبی مشخص شده است که از دست رفتن بینایی در لیپوفوشینوز سروئید عصبی ناشی از تخریب بافت های حس کننده نور در شبکیه است. با این حال یکی از موانع مطالعه از دست رفتن بینایی در بیماری Batten این است که مدل های موشی جهش در ژن CLN3، نمی توانند تخریب شبکیه یا از دست رفتن بینایی را در انسان ها به خوبی تقلید کنند و ارزیابی بافت چشم بعد از مرگ نیز به دلیل تخریب گسترده سلول های شبکیه برای مطالعه بافت چشم مناسب نیست. یک ابزار مناسب برای مطالعه بیماری Batten استفاده از سلول های خود بیمار است. محققین در دانشگاه روچستر سلول های پوستی بیماران را به سلول های بنیادی پرتوان القایی انسانی بازبرنامه ریزی کردند. در ادامه این سلول ها به سلول های شبکیه ای تمایز داده شده اند که دارای جهش CLN3 بودند.
با استفاده از این مدل سلولی انسانی جدید، برای اولین بار نشان داده شده است که عملکرد مناسب CLN3 برای ساختار سلول های اپی تلیوم رنگ دانه دار شبکیه لازم است. این لایه اپی تلیومی برای تغذیه سلول های گیرنده نوری شبکیه ضروری است و در نتیجه برای حفظ بقا و عملکرد آن ها نیز حیاتی است. درک این امر که عملکرد نامناسب سلول های اپی تلیومی رنگ دانه دار شبیکه می تواند منجر به از دست رفتن سلول های گیرنده نوری در بیماری باتن شود می تواند گام اولیه ای در جهت درمان این بیماری باشد.
Reference:https://medicalxpress.com/news/2021-02-vision-loss-batten-disease.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
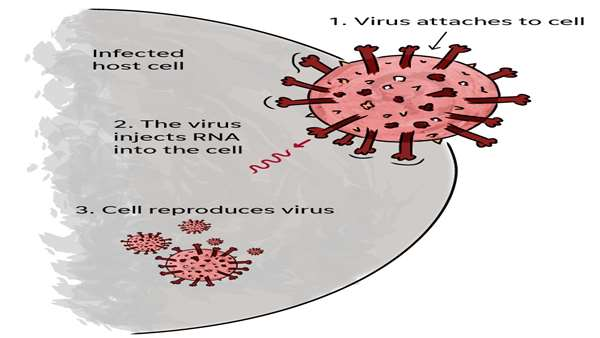
چگونگی مکانیسم مولکولی ورود ویروس کووید-19 همچنان برای دانشمندان ناشناخته است. بطوریکه کشف این مکانیسمها میتواند امیدواری بسیاری را برای واکسیناسون(با اشاره به حضور گیرندهای با نقش کلیدی در مسیر سیگنالینگ ورود ویروس) علیه این بیماری ایجاد نماید.
مطالعه حاضر که به تازگی در مجله Science Signaling به چاپ رسیده است به بررسی مکانیسم حمله این ویروس به سلول میزبان و نحوه ورود به آن پرداخته است.
در این پژوهش که محققان دانشگاه Uppsala با استفاده از نتایج مطالعهای بیوانفورماتیکی(که نتایج این مطالعه حاکی از حضور گیرندهای که نقش مهمی را در ایجاد مسیر سیگنالینگ ورود این ویروس به سلول میزبان را افشا میکند) به بررسی آزمایشگاهی این نتایج پرداخته است.
اگرچه امروزه مطالعات زیادی اشاره به نقش کلیدی گیرنده ACE2 برای ورود این ویروس به سلول میزبان دارند با این وجود مکانیسم سیگنالینگ دقیق ورود نامشخص است که این مطالعه تا حد زیادی به واضح شدن این مسیر اشاره دارد.
اساس این مطالعه برگرفته از نتایج حاصل از پژوهش محققان مرکز EMBL است که به معرفی و پیشگویی تعاملات پروتئینهایی پرداخته است که اثر نقش آنها را برای ورود ویروس به سلول میزبان محتمل میکند.
لذا در این پژوهش محققان دریافتند که ACE2 با همراهی Integrin beta 3 نقش مهمی را در فرایندهای جذب و دفع سلولی بازی میکنند. بنابراین شاید یکی از فرضیهها این باشد که این ویروس برای ورود به سلول این مکانیسمها را مختل میکند تا تحت تاثیر مکانیسمهای دفعی قرار نگیرد.
نویسنده این پژوهش اذعان داشت ما در این مطالعه دادههای حاصل از یک تحلیل بیوانفورماتیکی را مورد استفاده قرار دادیم تا ما را مستقیما به نتیجه دقیق تر نزدیک کند و برای آزمایشگاه ما که بررسی مطالعات تعاملی بین پروتئینها از اولویت مطالعاتی برخوردار است، ورود تحلیل های بیوانفورماتیکی از اهمیت بالایی برخوردار است.
https://www.eurekalert.org/pub_releases/2021-02/uu-nct020821.php
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
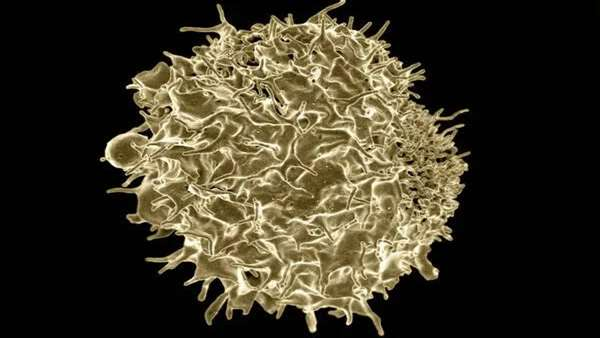
سلول های T برای حفاظت از بدن در برابر عفونت ها و سرطان حیاتی هستند و در این مطالعه جدید محققین روش جدیدی به نام CLInt-Seq را معرفی کرده اند که تکنیک های موجود برای جمع آوری و توالی یابی ژنتیکی سلول های T را به هم ترکیب می کند. بدن ما روزانه میلیون ها میلیون سلول T را تولید می کند و هر کدام از این سلول ها، گیرنده اختصاصی خود را برای شناسایی یک آنتی ژن خاص دارا است. یک گیرنده سلول T ممکن است یک آنتی ژن ویروسی را شناسایی کند که منجر به یک سرماخوردگی معمولی می شود و یک گیرنده دیگر ممکن است آنتی ژنی را شناسایی کند که مربوط به سلول سرطان سینه است. زمانی که سلول T با آنتی ژن مواجه می شود و گیرنده اش آن را شناسایی می کند، شروع به پاسخ می کند که این امر با تولید نسخه های بیشتر از خودش و هم چنین تحریک سایر سلول های ایمنی برای مقابله با آنتی ژن نمود پیدا می کند.
محققین در سراسر دنیا بدنبال روش هایی هستند که سلول های T با گیرنده های هدف قرار دهنده سرطان یا ویروسی مانند SARS-CoV-2 را جداسازی و تکثیر کنند و در ادامه به منظور تقویت سیستم ایمنی بیماران، آن ها را به بیماران بازگردانند. مشکلی که وجود دارد این است که اغلب جمعیت های سلولی که ما به آن ها دسترسی داریم، در خون محیطی شکل می گیرند یا از نمونه هایی بدست می آیند که در سایر بخش های بدن انسان وجود دارند و در نتیجه سلول های T با گیرنده مد نظر به ندرت در این جمعیت ها وجود دارند و باید به دنبال راهی برای برای جداسازی و شناسایی موثر آن ها بود. اغلب روش ها منجر به جمع آوری سلول های T می شود که دارای ناخالصی هستند. اما روشی مانند CLInt-Seq می تواند منجر به شناسایی سلول های T شود که گیرنده های مد نظر محققین را دارا هستند. جداسازی این سلول ها با گیرنده اختصاصی اولین گام محسوب می شود. برای استفاده موثر از این سلول های جداسازی شده، نیاز به آنالیز آن ها با استفاده از توالی یابی mRNA مبتنی بر قطره(droplet) یا Drop-seq است که می تواند بیان mRNA را به طور هم زمان در هزاران سلول منفرد اندازه گیری کند. زمانی که بتوانیم توالی گیرنده سلول T مد نظر را شناسایی کنیم، می توانیم از آن برای ایجاد درمان های موثرتر علیه سرطان، ویروس و ... استفاده کنیم.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

محققان دانشگاه ویرجینیا با بررسی چگونگی تأثیر ژن ها بر خطر ابتلا به بیماری عروق کرونر، شایع ترین شکل بیماری های قلبی را روشن کرده اند. آنها علاوه بر شناسایی انواع ژنی که بر این بیماری تأثیر می گذارد، دریافتند که به نظر می رسد به طور خاص یک ژن دارای اثر محافظتی باشد.
پزشکان ممکن است بتوانند از این یافته ها برای شناسایی افراد در معرض خطر، درمان های بهتر و مداخلات پیشگیرانه استفاده کنند.
دکتر Mete Civelek، دکترای گروه مهندسی پزشکی UVA ، گفت: "داروهای فعلی برای بیماری عروق کرونر عوامل خطر مانند کلسترول یا فشار خون بالا را درمان می کنند." اما مطالعات ما از رویکرد ژنتیکی برای شناسایی مکانیسم های دیواره رگ های خونی که بیماری در آن واقع شده است استفاده کرده است.
این تیم، ژنی به نام MIA3 را شناسایی کردند که برای اطمینان از کلاهک های محافظ ضخیم و پایدار بسیار مهم به نظر می رسد.
محققان اظهار عقیده می کنند این ژن پروتئینی تولید می کند که به نظر می رسد با ایجاد تکثیر سلولهای عضلانی صاف اثرات مفیدی در تشکیل کلاهک دارد. در مدل های آزمایشگاهی، کاهش فعالیت ژن کلاهک های نازک تر و پایدارتر را ایجاد می کند.
Civelek گفت: "اگر بتوانیم فراوانی پروتئین MIA3 را در سلولهای عضلانی صاف افزایش دهیم ، ممکن است بتوانیم از حملات قلبی جلوگیری کنیم."
https://medicalxpress.com/news/2020-12-gene-discovery-heart.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
یکی از پیشرفت های بزرگ در زمینه پیوند سلول های بنیادی کشف سلول های بنیادی خون ساز بود که قادرند تمام رده های سلول های خونی را تولید کنند. دومین پیشرفت کشف زیست مولکول های قندی موسوم به گلیکان ها روی سطح سلول ها بود که نقش مهمی را زیست شناسی انسانی بازی می کنند و بدن ما از آن ها برای شناسایی و مبارزه با سلول های بیمار استفاده می کند. بازبرنامه ریزی سلول ها به سلول های بنیادی و پیش ساز خون ساز(HSPCs) به یک امر موثر برای پیوند سلول های بنیادی اتولوگ به عنوان یک رویکرد درمانی برای برخی سرطان های خونی تبدیل شده است.
با این حال، مکانیسم هایی که این تبدیل شدن را تنظیم می کنند، در سطح مولکولی و سلولی به خوبی شناخته نشده اند. در مطالعه ای جدید، محققین دریافته اند که miR-223 یک ارتباط حیاتی بین قندهای پیچیده موسوم به گلیکان ها ها و گذار اندوتلیالی به هماتوپوئیتیکی(خون سازی، EHT) است؛ فرایندی که در آن اندوتلیوم خون ساز به سلول های بنیادی و پیش ساز خون ساز تمایز می یابد. با ترکیب زیست شناسی تحلیلی، ساختاری و سلولی، محققین دریافتند که پروتئین ها روی سطح سلول های اندوتلیالی بوسیله یک کد قندی خاص موسوم به ان-گلیکان مدیفه می شوند و همین امر تولید خون بوسیله آن ها را محدود می کند.
این زیست مولکول فعالیت تنظیم کننده های خون سازی را محدود می کند. این یافته می تواند دو کاربرد بالقوه داشته باشد: اول این که یک روش بهبود یافته را برای تولید سلول های بنیادی و با شانس موفقیت بیشتر ارائه می کند و دوم این که می تواند کاربرد گسترده ای در درمان سرطان داشته باشد و به محققین اجازه استفاده از مهندسی قندها برای تغییر سطح سلول ها و اثر گذاری روی پیشرفت سرطان را می دهد.
Reference:https://medicine.yale.edu/news-article/28757/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
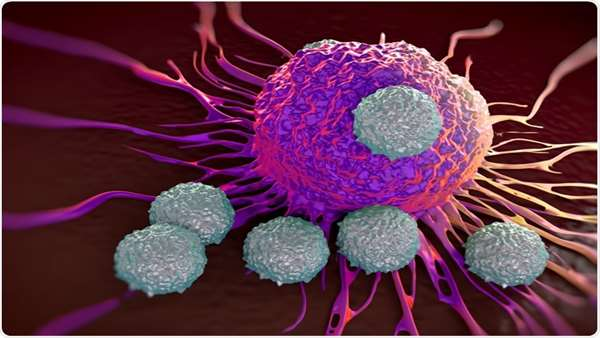
پژوهشگران مرکز سرطان MUSC Hollings دریافته اند که بعد از پیوند سلول های بنیادی خون ساز، بلوک کردن مسیر انرژی جایگزین برای سلول های T می تواند به کاهش بیماری پیوند علیه میزبان(GvHD) در مدل های جانوری لوکمیا کمک کند. در این پژوهش جدید دکتر ژو ژانگ یو و همکارانش کشف کرده اند که سلول های T اهدایی برای القای GvHD باید دارای آنزیم کلیدی اسید لیپاز لیزوزومی باشند.
در این پژوهش آن ها روی درک تعادل زیستی بین GvHD و اثر پیوند علیه لوکمیا فوکوس کردند. پیوند سلول های بنیادی خون ساز به عنوان گزینه ای درمانی برای برخی از بیماران لوکمیایی استفاده می شود. سلول های T در گرافت سلول های بنیادی مشتق از اهدا کننده به بیماران لوکمیایی داده می شوند تا سلول های سرطانی را بکشند و سیستم ایمنی بیماران را مجددا بازسازی کنند. بیماری GvHD یک چالش بالینی بزرگ محسوب می شود زیرا سلول های T اهدایی که از مغز استخوان منشا می گیرند می توانند به اندام های بیماران حمله کنند.
معمولا 30 تا 70 درصد بیمارانی که متحمل پیوند مغز استخوان آلوژن می شود دچار GvHD می شوند و 15 درصد آن ها می میرند. هر سلول در بدن ما فرایند متابولیکی خودش را دارد ولی این متابولیسم معمولا طی بیماری های مختلف تغییر می کند. در مطالعه صورت گرفته در مرکز سرطان MUSC Hollings، محققین روی متابولیسم سلول های T فوکوس کردند تا تعادل بین GvHD و پاسخ های گرافت علیه لوکمیا را درک کنند. اغلب سلول های بدن برای تامین موثر انرژی به اکسیژن نیاز دارند.
با این حال، این مطالعه روی متابولیسم چربی فوکوس کرد. سلول های T دارای فرایندهای متابولیکی ویژه ای هستند و گاهی به دلیل تکثیر سریعی که دارند نیازمند استفاده از یک منبع انرژی اضافی در قالب اسیدهای چرب آزاد هستند. لیپاز اسید لیزوزومی آنزیمی است که لیپیدهای بزرگ و کلسترول را به اسیدهای چرب می شکند. اگر این آنزیم وجود نداشته باشد، اسیدهای چرب کافی برای تولید انرژی وجود ندارد. این تغییر متابولیسم سلول های T را تغییر می دهد که آن هم به نوبه خود موجب تغییر در عملکرد سلول های T می شود. در مطالعه روی مدل های موشی لوکمیا، محققین از مهار کننده لیپاز اسید لیزوزومی به نام اولیستات استفاده کردند(یک روز بعد از دریافت پیوند مغز استخوان). مهار آنزیم بوسیله این مهار کننده موجب کاهش قابل توجه GvHD در این موش ها شد. به عقیده محققین با انجام آزمایشات بیشتر می توان در آینده ای نزدیک از این استراتژی برای درمان GvHD انسانی استفاده کرد.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
محققین نشان داده اند که پروتئین BAHCC1 نقش حیاتی در خاموش سازی ژن ها بازی می کند و به عنوان یک جزء کلیدی برای مسیر سرکوب کننده ژن Polycomb در سلول های پستانداران عمل می کند. در سلول ها، مسیر Polycomb یک برچسب شیمیایی کوچک(H3K27me3) را برای خاموش کردن ژن ها تولید می کند. بازیگران مولکولی مرتبط با Polycomb و H3K27me3 به وفور یافت می شوند و با بیماری زایی و بویژه سرطان و سندرم های تکوینی مرتبط هستند. پیش از این محققین نشان داده بودند که BAHCC1 با سرطان و بویژه لوکمیا مرتبط هستند ولی در مورد آن اطلاعات اندکی در دسترس است. به عقیده آن ها مطالعه این پروتئین می تواند راهی مناسب برای درک اساسی نقش ژن Polycomb و خاموش سازی ژن باشد.
لوکمیا سرطانی است که خون و مغز استخوان را هدف قرار می دهد و سالانه بیش از 60 هزار نفر در آمریکا مبتلا به این سرطان تشخیص داده می شوند. در مطالعه جدید صورت گرفته در دانشگاه کارولینا محققین با تحلیل گذشته نگر داده های منتشر شده تاکنون بیان بالای ژن BAHCC1 را در انواع مختلف لوکمیا نشان دادند. با استفاده از فناوری ویرایش ژنومی CRISPR/Cas9 آن ها وابستگی مدل های مختلف لوکمیای حاد به BAHCC1 برای پیشرفت بیماری را نشان داده اند. آن ها نشان داده اند که BAHCC1 سرکوب کننده های توموری را مهار می کند تا موجب پیشرفت لوکمیا شود. این عملکرد BAHCC1 به توانایی آن برای اتصال به H3K27me3 بستگی دارد تا برخی از ژن ها خامو شوند. محققین پروتئین BAHCC1 و اتصال آن به H3K27me3 را هدف مناسبی برای مقابله با سرطان لوکمیا و طراحی داروها و درمان های جدید می دانند.
Reference: https://www.nature.com/articles/s41588-020-00729-3
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
در پژوهشی جدید محققین دانشگاه Duke تعدادی جهش "خاموش" را در حدود 30،000 حرف کد ژنتیکی ویروس شناسایی کرده اند که پس از جهش ویروس باعث رشد آن می شود و احتمالاً زمینه را برای همه گیری جهانی فراهم می کند. این تغییرات ظریف شامل چگونگی فولد شدن مولکول های RNA ویروس در سلولهای انسانی بود. در مطالعه ای که در مجله PeerJ منتشر شد، محققان از روشهای آماری برای شناسایی تغییرات سازگار در ژنوم SARS-CoV-2 در انسان استفاده کردند، اما اطلاعات به دست آمده خیلی شباهت به تغییرات موجود در ویروس کرونا خفاش ها نداشت .
نویسنده اصلی این مقاله در دانشگاه دوک گفت: "ما در تلاشیم بفهمیم چه چیزی این ویروس را منحصر به فرد کرده است." تحقیقات قبلی، ژنی را کشف نموده است که پروتئین هایSpike که روی سطح ویروس کرونا قرار دارند را رمزگذاری می کند، که این پروتئین ها نقش مهمی در توانایی آلوده سازی سلول های جدید دارند. مطالعه ذکر شده ترتیب جهش هایی را نشان داد که باعث تغییر پروتئین های Spike می شوند و حاکی از آن است که سویه های ویروسی حامل این جهش ها به احتمال زیاد قادر به رشد خواهند بود. محققان گزارش دادند که به نظر می رسد جهش های به اصطلاح خاموش در دو منطقه دیگر از ژنوم SARS-CoV-2 ، به نام های Nsp4 و Nsp16 وجود دارند. به نظر می رسد ویروس یک مرز بیولوژیکی نسبت به سویه های قبلی دارد بدون اینکه پروتئین های رمزگذاری شده آن تغییر کند. این تغییرات به جای تاثیر بر پروتئین ها، احتمالاً روی مواد ژنتیکی ویروس که از RNA ساخته شده است، اثر می گذارند که این مواد ژنتیکی شکل خاصی به خود گرفته و قادر باشند در داخل سلول های انسان عمل کنند.
Nsp4 و Nsp16 از جمله اولین مولکول های RNA هستند که با آلوده شدن فرد جدید به ویروس تولید می شوند. به طور کلی، با مشخص کردن تغییرات ژنتیکی که باعث رشد ویروس کرونا در میزبان های انسانی می شود، دانشمندان امیدوارند که شیوع بیماری مشترک انسان و سایر موجودات را پیش از وقوع بهتر پیش بینی کنند. ویروسها دائماً در حال جهش و تحول هستند. بنابراین ممکن است یک کرونا ویروس جدید که قادر به آلوده کردن حیوانات دیگر است نیز وجود داشته باشد که همچنان ممکن است مانند SARS-CoV-2 به مردم سرایت کند.
Reference: https://peerj.com/articles/10234/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
محققان نشان داده اند که پروتئین های کراتین در جنین اولیه و مرحله هشت سلولی جنین، نقش مهمی را در تنوع سلول به سلول بازی می کنند. در مرحله بلاستوسیستی، این ناهمگونی خودش را به صورت شبکه متراکمی از کراتین ها در تروفواکتودرم نشان می دهد و این با عدم بیان کراتین در توده داخلی سلولی(ICM) همراه است. تصویربرداری زنده با استفاده از mRNA کراتین نشان دار شده به صورت فلورسنت نشان دهنده سازمان دهی شدن فیلامنت های کراتین در ناحیه راسی سلول ها در مرحله اینترفاز است که منجر به توارث غیر متقارن فیلامنت های کراتین به سلول های دختری تبدیل شونده به تروفواکتودرم می شود. این در حالی است که سلول های دختری فاقد کراتین به نوعی درون روی می کنند و به سلول های توده داخلی تبدیل می شوند که در آینده لایه های جنینی و سلول های تخصص یافته جنین را تولید می کنند.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
به دنبال یک تحقیق مشترک بین مرکز تحقیقات سلولهای بنیادی دانشگاه واشنگتن و دانشگاه Rice پروژه ای طراحی شد تا در آن روشی برای کنترل میزان رشد بافت های مصنوعی ایجاد کنند.
در این مطالعه از مبدل و مسیرهای حرارتی برای تحریک فرایند رونویسی استفاده شد که از آن با نام (HEAT) یاد شده است. این پژوهش در مجله Science Advances به چاپ رسیده است.
بیش از 500 میلیون نفر در سراسر جهان از بیماری کبدی رنج می برند از این رو دانشمندان حوزه مهندسی بافت تلاش میکنند تا با تولید ارگان های مصنوعی، عملکردهای از دست رفته این بیماری ها را احیا کنند، با این وجود موانع زیادی وجود دارد که می بایست برطرف شوند.
این تیم در تحقیقات خود ، با به کارگیری یک سیستم گردش مایع در چاپگر سه بعدی، بستری را برای انتقال گرما به یک مکان خاص در داخل بافت فراهم نموده است تا بیان ژن های آن ناحیه را دستخوش تغییرات قرار دهد و شکلگیری سه بعدی ارگانی همچون کبد را تسهیلکند.
آخرین یافته های این تیم پژوهشی حاکی از آن است که استفاد از این تکنولوژی بواسطه فعال کردن مسیر سیگنالینگ WNT ، نقش بسیار مهمی در پایداری و رشد ارگان بازی میکند.همچنین محققان این پؤوژه معتقدند که این روش نه تنها برای تولید و رشد اندام میتواند مناسب باشد بلکه در ایجاد بستر مناسب برای پیوند اعضا نیز موثر است.
از نقایص این طرح که همچنان در حال بررسی برای ارتقا آن هستند، این است که دمای انتقال داده شده در مناطق مختلف می بایست کنترل شده اعمال شود، با این وجود محققین امیدوار اند که این روش جدید نشان دهد که چگونه الگوهای ژنتیکی میتواند بر روی تفکیک بافتها و عملکرد بخش های مختلف کبد اثر گذارد.
در نتیجه نویسنده مقاله اذعان داشت " روشHEAT به عنوان روشی نوین برای تنظیم بیان ژن در مقایسه با سایر ابزارهای همچون ترکیبات شیمیایی و یا استفاده از پرتو به حساب میآید." لذا پژوهشگران این مطالعه معتقدند که این روش میتواند نگرشی جدید را در حوزه مهندسی بافت ایجاد کند.
Link:https://www.regmednet.com/artificial-organ-growth-manipulated-by-novel-3d-printed-fluid-system/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
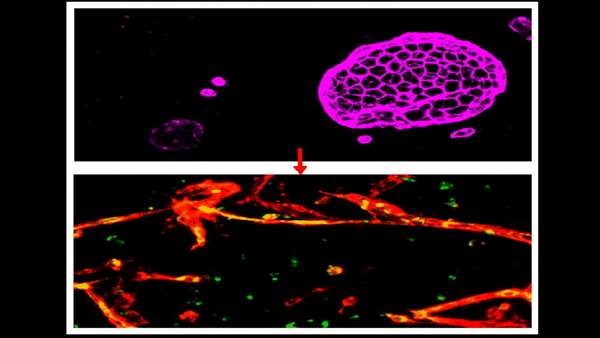
مطالعه سد خونی-مغزی در انسان مشکل است و استفاده از مدل های جانوری نیز به دلیل وجود تفاوت های فیزیولوژیک و آناتومیک متفاوت قابل اتکا نمی باشند. به همین دلیل دکتر دریتان آگالیو و همکارانش در دانشگاه ویل کورنل از پتانسیل سلول های بنیادی پرتوان القایی(iPSCs) برای تولید یک سد خونی-مغزی دارای عملکرد استفاده کرده اند.
آن ها این سلول های پرتوان را با استفاده از پروتکلی خاص به سلول های اندوتلیالی تمایز دادند که عروق خونی مغز و طناب نخاعی را مفروش می کنند و یک سد منحصربفرد را شکل می دهند که ورود مواد خطرناک، آنتی بادی ها و سلول های ایمنی از خون به مغز را مهار می کند. پروتکل تمایزی مورد استفاده بوسیله محققین منجر به بیان سه ژن در این سلولهای اندوتلیالی شده است که در نفوذ پذیری انتخابی شان نسبت به مواد مختلف و جلوگیری از عبور مواد خطرناک دخیل هستند. به همین دلیل این سلول ها می توانند برای مدل سازی سد خونی-مغزی استفاده شوند و از آن ها برای مطالعه بیماری های عصبی مربوط به اختلال سد خونی-مغزی و هم چنین غربالگری داروهای عصبی استفاده شود.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
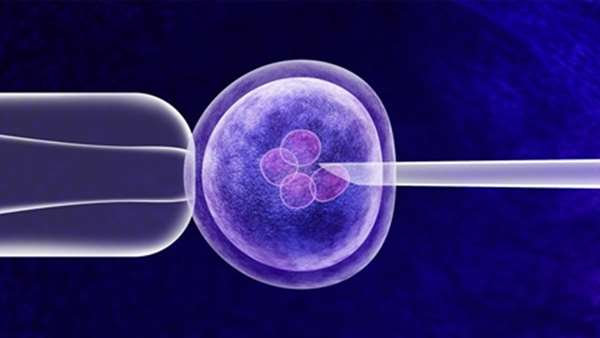
مسیری نوین برای درمان بیماریها؛ با ژندرمانی آشنا شویم
حوزه پزشکی به کمک سلولهای بنیادی، متحول شده است و بسیاری از بیماریهای شکستناپذیر با تکیه به فناوریهای پیشرفته درمان میشوند.
فناوری ژن درمانی یا ژنتراپی یکی از روشهای نوآورانهای است که در معدودی از کشورهای پیشتاز در حوزه پزشکی به عنوان راهکاری اثربخش برای درمان بیماریهای صعبالعلاج به کار میبرند. این نوع درمان، یک روش تجربی است که از ژن برای درمان یا پیشگیری از بیماری استفاده می کند.
در آیندهای نه چندان دور، این روش ممکن است به پزشکان اجازه دهد تا به جای استفاده از دارو یا جراحی، با قرار دادن یک ژن در سلولهای بیمار، یک اختلال را درمان کنند. محققان چندین روش برای ژن درمانی را آزمایش می کنند.
اگرچه ژن درمانی یک گزینه درمانی امیدوار کننده برای تعدادی از بیماری ها، از جمله اختلالات ارثی، برخی از انواع سرطان و برخی از عفونت های ویروسی است. اما این روش همچنان در حال توسعه و آزمایشهای بیشتری است و برای اطمینان از ایمن و موثر بودن آن پژوهشهای متعددی در حال انجام هنوز در دست مطالعه است. ژن درمانی در حال حاضر فقط برای بیماریهایی که هیچ درمان دیگری ندارند استفاده می شود.
افقهای پیش روی ژن درمانی
ژن درمانی توسط پژوهشگران در دست بررسی است تا مشخص شود آیا میتواند برای درمان بیماریها مورد استفاده قرار گیرد. تحقیقات فعلی ارزیابی ایمنی ژن درمانی را مورد بررسی قرار دادهاند و درباره اینکه ژن درمانی بر روی درمان چه بیماریهایی مؤثر است، تحقیق کردهاند.
قوانین، مقررات و دستورالعمل های جامع برای پیاده سازی روشهای مبتنی بر ژن درمانی وجود دارد و محققانی که قصد دارند از این روش در یک کارآزمایی بالینی استفاده کنند، میبایست با استفاده از این دستورالعملها کار پژوهشی خود را پیش ببرند.
قبل از انجام هر آزمایش بالینی ژن درمانی، باید این روش به لحاظ ایمنی زیستی تأیید شود تا خطرناک بودن یک پژوهش برای سلامت مورد بررسی و آن روش مورد تایید قرار بگیرد.
با توجه به اهمیت و کاربردهای روزافزون روشهای ژن درمانی در پزشکی، شرکتهای دانشبنیان و پژوهشگاههای فعال در حوزه سلولهای بنیادی، در مسیر فناوریهای ژن درمانی گام برداشته است. در حال حاضر مجموعه اختصاصی تولید فرآوردههای ژن درمانی با استانداردهای جهانی در کشور ارائه میشود.
مرکز تولید فرآورده های ژن درمانی سوئیت تولید، با قابلیت فراوری وکتورهای انتقال ژن ویروسی و سلول های دست ورزی شده با این وکتورها یکی از دستاوردهای کشور در پژوهشگاه رویان برای فعالیت در حوزه ژن، همچنین اتاقهایی برای بانک های وکتور و سلول و نیز انبار و آماده سازی مواد اولیه در نظر گرفته شده است. کلیه استانداردهای GMP در طراحی و ساخت این مجموعه در نظر گرفته شده است.
در کشورمان نیز پژوهشها و محصولات دانشبنیان در حوزه ژن درمانی و سلول درمانی در مسیر توسعه و پیشرفت قرار دارد و دستاوردهای ارزشمند در این حوزه به دست آمده است.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
امروزه استفاده از سلول های بنیادی خونساز به عنوان یک راهکار درمانی مناسب، دامنه وسیعی از سرطانهای صعب العلاج، بیماریهای خونی، ژنتیکی و خودایمنی را پوشش میدهد. اما متاسفانه تعداد این سلول های بنیادی در مغز استخوان یک فرد بالغ، 1 به ازای 2500 سلول خونی می باشد. در این مطالعه بیوانفورماتیکی، محققان با گسترش یک الگوریتم به نام VIPER، موفق به کشف پروتئینی شدند که در باز برنامه نویسی سلول های بنیادی خونساز نقش ایفا میکنند.
این الگوریتم موفق به شناسایی پروتئین کد شaونده ای از ژن BAZ2B شد، که نقش بسیار تاثیر گذاری در تقسیم و افزایش تعداد سلول های بنیادی خونساز درخون بند ناف ایفا میکند. این ژن با حضور در چندین مسیر زیستی، موجب فعال سازی مناطقی از ژنوم می شود که تا قبل از آن در سلول تمایز یافته غیر قابل دسترس بوده است.
لذا موجب بازگردانی سلولهای خونی تمایز یافته به سلول های بنیادی خونساز می شود. در این مطالعه به منظور نشان دادن زنده مانی و حفظ قدرت تقسیم و تمایز سلول های بنیادی حاصل از سلول های تمایز یافته، سلول های حاصل شده به یک موش مدل پیوند زده شد و نتایج آن گزارش گردید. قابل ذکر است که الگوریتم VIPER نه تنها در این مطالعه بلکه پتانسیل بررسی سایر پروتئین های حیاتی در رشد و تقسیم و تمایز سلول های بنیادی را دارا می باشد.
References: https://phys.org/news/2020-12-method-boost-life-saving-stem-cells.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
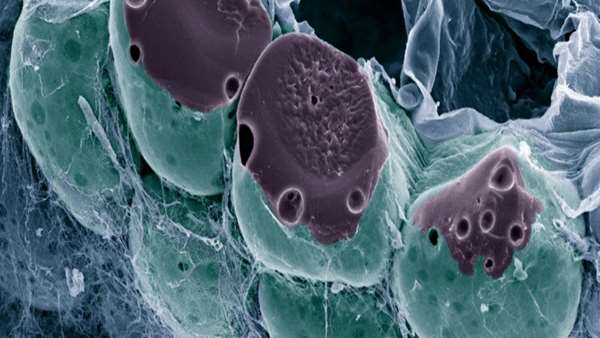
سلول های بنیادی مشتق از چربی می توانند به بیماران مبتلا به زخم پای دیابتی غیر قابل بهبود کمک کنند
در پروژه ای مشترک تیمی از انستیتوی پزشکی ایالات متحده آمریکا با محققان دانشگاه ملی نیکاراگوئه آزمایشی را طراحی نمودند که در آن به بررسی تاثیر استفاده از سلولهای بنیادی و SVF استخراج شده از بافت چربی، بر روی زخم های دیابتی پرداختند.
نتایج مطالعه فاز I ، منتشر شده در Stem Cells Translational Medicine ، نشان داد که SVF استخراج شده می توانند تشکیل عروق خونی را القا کنند و ترمیم زخم را تسریع کنند.
مایکل کارستنز (از محققین این پروژه) توضیح داد: "درمان بیماریهای عروقی و زخم های مزمن به دلیل بیماری عروق سطحی و یا دیابت، در کشورهای فقیرنشین مانند نیکاراگوئه دشوار است."
وی گفت: "بیماران برای دریافت مراقبت های پزشکی معمولاً مجبورند مسافت طولانی را در شرایط نامناسب جاده طی کنند. پیوند عروق برای اکثر مردم از نظر اقتصادی امکان پذیر نیست و روشهای پیشرفته تر همچون استفاده از سلولهای بنیادی که به امکانات پردازش سلول نیاز دارند چالشهای قابل توجهی از نظر لجستیکی و اقتصادی به دنبال دارد. در چنین شرایطی، زخم های ایسکمیک غیرقابل ترمیم، بیماران و پزشکان را با گزینه های ناخوشایندی همچون: درد مزمن و خطر عفونت یا قطع عضو مواجه می کند. "
در این مطالعه 63 فرد در سنین 35 تا 70 سال که مبتلا به دیابت نوع 2 و زخم پای دیابتی مزمن بودند، داوطلب شدند بطوریکه همه شرکت کنندگان کاندیدای قطع اندام بودند.
در ابتدا با استخراج چربی از خود بیماران و استخراج SVF ، به خود آن ها تزریق نمودند. این تزریق در بستر زخم ، اطراف محیط و در امتداد شریان های پا (dorsalis pedis و tibialis poserior) انجام گردید.
ارزیابی پیگیری از زخمهای دیابتی در فواصل 6 و 12 ماه انجام شد. پس از 12 ماه ، 50 نفر از شرکت کنندگان 100٪ بهبود زخم داشتند در حالی که چهار نفر بهبودی بیش از 85٪ داشتند.
کارستن ادامه داد: "روند بهبودی همانطور که انتظار می رفت در دو جهت مختلف مشاهده شد: از حاشیه و رو به قسمت داخلی از بستر زخم انجام شد." "در چندین مورد ، بافت تازه توسعه یافته قادر به پوشاندن تاندون هایی شد که سابقا در معرض دید بود. بعلاوه ، حتی در بین زخمهای بزرگتر از 10 سانتی متر مربع نیز عملاً کلیه بیماران در 6 ماهگی 85٪ بهبودی به دنبال داشتند. اما هیچ ارتباطی بین اندازه و بسته شدن زخم مشاهده نشد. "
در نهایت محققان امیدوارند که پس از بررسی های بالینی بیشتر ، تزریق SVF به یک درمان ایمن و موثر برای زخم های پای دیابتی تبدیل شود و از تحلیل رفتن اندام جلوگیری کند.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

در مطالعه ای جدید محققین با استفاده از سلول های بنیادی پرتوان القایی(iPSCs)، سلول های مغزی شامل نورون ها و آستروسیت ها را تولید کرند و در ادامه آن ها را با SARS-CoV-2 آلوده کردند و مشاهده کردند که هر دو نوع سلول به آلودگی مستعد بودند. در ادامه از این سلول های iPS برای تولید ارگانوئیدهای مغزی استفاده شد که یکی از آن ها دارای آستروسیت و دیگری فاقد آستروسیت بودند. بررسی ها نشان داد که ارگانوئیدهای دارای آستروسیت آلودگی بسیار شدیدتری را نسبت به SARS-CoV-2 نشان دادند.
در بخش بعدی مطالعه محققین سعی در بررسی اثر ApoE4 روی حساسیت به SARS-CoV-2 داشتند و آن ها نورون ها و آستروسیت هایی را از iPSCs مشتق از بیماران مبتلا به آلزایمر و دارای ApoE4 تولید کردند. نتایج نشان داد که نورون ها و آستروسیت های ApoE4 هر دو شدیدا به SARS-CoV-2 حساس هستند و میزان آسیب به این نورون ها در مقایسه با نورون های طبیعی و نورون های ApoE3 به مراتب بیشتر بود.
در بخش انتهایی مطالعه، محققین داروی ضد ویروسی remdesvir را برای مهار آلودگی ویروسی در نورون ها و آستروسیت ها تست کردند و مشاهده کردند که این دارو با موفقیت سطح آلودگی ویروسی را در آستروسیت ها کاهش داد و مانع از مرگ سلولی شد. هم چنین تخریب نورون ها را نیز مهار کرد.
به عقیده محققین افزایش دانسته ها در مورد COVID-19 می تواند راهگشای ایجاد راهکارهای درمانی بیشتر برای این بیماری همه گیر باشد.
https://medicalxpress.com/news/2021-02-explore-link-alzheimer-gene-covid-.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470




