سلول های بنیادی راهی به آینده
-

بیماری Batten به دلیل جهش در ژن CLN3 رخ می دهد که روی کروموزوم 16 قرار دارد. اغلب کودکان مبتلا به این بیماری بخشی از ژن شان از بین رفته است که همین امر مانع از تولید پروتئین های خاص می شود. از دست رفتن بینایی در اوایل چهار سالگی شروع می شود و روی یادگیری و رفتار فرد نیز اثراتی را بر جای می گذارد و آن ها در نهایت بین سنین 15 تا 30 سالگی می میرند.
به خوبی مشخص شده است که از دست رفتن بینایی در لیپوفوشینوز سروئید عصبی ناشی از تخریب بافت های حس کننده نور در شبکیه است. با این حال یکی از موانع مطالعه از دست رفتن بینایی در بیماری Batten این است که مدل های موشی جهش در ژن CLN3، نمی توانند تخریب شبکیه یا از دست رفتن بینایی را در انسان ها به خوبی تقلید کنند و ارزیابی بافت چشم بعد از مرگ نیز به دلیل تخریب گسترده سلول های شبکیه برای مطالعه بافت چشم مناسب نیست. یک ابزار مناسب برای مطالعه بیماری Batten استفاده از سلول های خود بیمار است. محققین در دانشگاه روچستر سلول های پوستی بیماران را به سلول های بنیادی پرتوان القایی انسانی بازبرنامه ریزی کردند. در ادامه این سلول ها به سلول های شبکیه ای تمایز داده شده اند که دارای جهش CLN3 بودند.
با استفاده از این مدل سلولی انسانی جدید، برای اولین بار نشان داده شده است که عملکرد مناسب CLN3 برای ساختار سلول های اپی تلیوم رنگ دانه دار شبکیه لازم است. این لایه اپی تلیومی برای تغذیه سلول های گیرنده نوری شبکیه ضروری است و در نتیجه برای حفظ بقا و عملکرد آن ها نیز حیاتی است. درک این امر که عملکرد نامناسب سلول های اپی تلیومی رنگ دانه دار شبیکه می تواند منجر به از دست رفتن سلول های گیرنده نوری در بیماری باتن شود می تواند گام اولیه ای در جهت درمان این بیماری باشد.
Reference:https://medicalxpress.com/news/2021-02-vision-loss-batten-disease.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
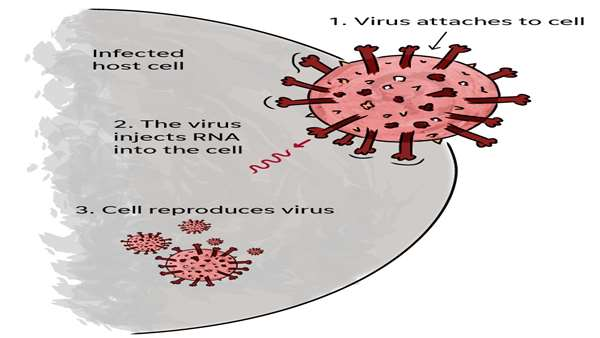
چگونگی مکانیسم مولکولی ورود ویروس کووید-19 همچنان برای دانشمندان ناشناخته است. بطوریکه کشف این مکانیسمها میتواند امیدواری بسیاری را برای واکسیناسون(با اشاره به حضور گیرندهای با نقش کلیدی در مسیر سیگنالینگ ورود ویروس) علیه این بیماری ایجاد نماید.
مطالعه حاضر که به تازگی در مجله Science Signaling به چاپ رسیده است به بررسی مکانیسم حمله این ویروس به سلول میزبان و نحوه ورود به آن پرداخته است.
در این پژوهش که محققان دانشگاه Uppsala با استفاده از نتایج مطالعهای بیوانفورماتیکی(که نتایج این مطالعه حاکی از حضور گیرندهای که نقش مهمی را در ایجاد مسیر سیگنالینگ ورود این ویروس به سلول میزبان را افشا میکند) به بررسی آزمایشگاهی این نتایج پرداخته است.
اگرچه امروزه مطالعات زیادی اشاره به نقش کلیدی گیرنده ACE2 برای ورود این ویروس به سلول میزبان دارند با این وجود مکانیسم سیگنالینگ دقیق ورود نامشخص است که این مطالعه تا حد زیادی به واضح شدن این مسیر اشاره دارد.
اساس این مطالعه برگرفته از نتایج حاصل از پژوهش محققان مرکز EMBL است که به معرفی و پیشگویی تعاملات پروتئینهایی پرداخته است که اثر نقش آنها را برای ورود ویروس به سلول میزبان محتمل میکند.
لذا در این پژوهش محققان دریافتند که ACE2 با همراهی Integrin beta 3 نقش مهمی را در فرایندهای جذب و دفع سلولی بازی میکنند. بنابراین شاید یکی از فرضیهها این باشد که این ویروس برای ورود به سلول این مکانیسمها را مختل میکند تا تحت تاثیر مکانیسمهای دفعی قرار نگیرد.
نویسنده این پژوهش اذعان داشت ما در این مطالعه دادههای حاصل از یک تحلیل بیوانفورماتیکی را مورد استفاده قرار دادیم تا ما را مستقیما به نتیجه دقیق تر نزدیک کند و برای آزمایشگاه ما که بررسی مطالعات تعاملی بین پروتئینها از اولویت مطالعاتی برخوردار است، ورود تحلیل های بیوانفورماتیکی از اهمیت بالایی برخوردار است.
https://www.eurekalert.org/pub_releases/2021-02/uu-nct020821.php
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
سلول های T برای حفاظت از بدن در برابر عفونت ها و سرطان حیاتی هستند و در این مطالعه جدید محققین روش جدیدی به نام CLInt-Seq را معرفی کرده اند که تکنیک های موجود برای جمع آوری و توالی یابی ژنتیکی سلول های T را به هم ترکیب می کند. بدن ما روزانه میلیون ها میلیون سلول T را تولید می کند و هر کدام از این سلول ها، گیرنده اختصاصی خود را برای شناسایی یک آنتی ژن خاص دارا است. یک گیرنده سلول T ممکن است یک آنتی ژن ویروسی را شناسایی کند که منجر به یک سرماخوردگی معمولی می شود و یک گیرنده دیگر ممکن است آنتی ژنی را شناسایی کند که مربوط به سلول سرطان سینه است. زمانی که سلول T با آنتی ژن مواجه می شود و گیرنده اش آن را شناسایی می کند، شروع به پاسخ می کند که این امر با تولید نسخه های بیشتر از خودش و هم چنین تحریک سایر سلول های ایمنی برای مقابله با آنتی ژن نمود پیدا می کند.
محققین در سراسر دنیا بدنبال روش هایی هستند که سلول های T با گیرنده های هدف قرار دهنده سرطان یا ویروسی مانند SARS-CoV-2 را جداسازی و تکثیر کنند و در ادامه به منظور تقویت سیستم ایمنی بیماران، آن ها را به بیماران بازگردانند. مشکلی که وجود دارد این است که اغلب جمعیت های سلولی که ما به آن ها دسترسی داریم، در خون محیطی شکل می گیرند یا از نمونه هایی بدست می آیند که در سایر بخش های بدن انسان وجود دارند و در نتیجه سلول های T با گیرنده مد نظر به ندرت در این جمعیت ها وجود دارند و باید به دنبال راهی برای برای جداسازی و شناسایی موثر آن ها بود. اغلب روش ها منجر به جمع آوری سلول های T می شود که دارای ناخالصی هستند. اما روشی مانند CLInt-Seq می تواند منجر به شناسایی سلول های T شود که گیرنده های مد نظر محققین را دارا هستند. جداسازی این سلول ها با گیرنده اختصاصی اولین گام محسوب می شود. برای استفاده موثر از این سلول های جداسازی شده، نیاز به آنالیز آن ها با استفاده از توالی یابی mRNA مبتنی بر قطره(droplet) یا Drop-seq است که می تواند بیان mRNA را به طور هم زمان در هزاران سلول منفرد اندازه گیری کند. زمانی که بتوانیم توالی گیرنده سلول T مد نظر را شناسایی کنیم، می توانیم از آن برای ایجاد درمان های موثرتر علیه سرطان، ویروس و ... استفاده کنیم.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

محققان دانشگاه ویرجینیا با بررسی چگونگی تأثیر ژن ها بر خطر ابتلا به بیماری عروق کرونر، شایع ترین شکل بیماری های قلبی را روشن کرده اند. آنها علاوه بر شناسایی انواع ژنی که بر این بیماری تأثیر می گذارد، دریافتند که به نظر می رسد به طور خاص یک ژن دارای اثر محافظتی باشد.
پزشکان ممکن است بتوانند از این یافته ها برای شناسایی افراد در معرض خطر، درمان های بهتر و مداخلات پیشگیرانه استفاده کنند.
دکتر Mete Civelek، دکترای گروه مهندسی پزشکی UVA ، گفت: "داروهای فعلی برای بیماری عروق کرونر عوامل خطر مانند کلسترول یا فشار خون بالا را درمان می کنند." اما مطالعات ما از رویکرد ژنتیکی برای شناسایی مکانیسم های دیواره رگ های خونی که بیماری در آن واقع شده است استفاده کرده است.
این تیم، ژنی به نام MIA3 را شناسایی کردند که برای اطمینان از کلاهک های محافظ ضخیم و پایدار بسیار مهم به نظر می رسد.
محققان اظهار عقیده می کنند این ژن پروتئینی تولید می کند که به نظر می رسد با ایجاد تکثیر سلولهای عضلانی صاف اثرات مفیدی در تشکیل کلاهک دارد. در مدل های آزمایشگاهی، کاهش فعالیت ژن کلاهک های نازک تر و پایدارتر را ایجاد می کند.
Civelek گفت: "اگر بتوانیم فراوانی پروتئین MIA3 را در سلولهای عضلانی صاف افزایش دهیم ، ممکن است بتوانیم از حملات قلبی جلوگیری کنیم."
https://medicalxpress.com/news/2020-12-gene-discovery-heart.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
یکی از پیشرفت های بزرگ در زمینه پیوند سلول های بنیادی کشف سلول های بنیادی خون ساز بود که قادرند تمام رده های سلول های خونی را تولید کنند. دومین پیشرفت کشف زیست مولکول های قندی موسوم به گلیکان ها روی سطح سلول ها بود که نقش مهمی را زیست شناسی انسانی بازی می کنند و بدن ما از آن ها برای شناسایی و مبارزه با سلول های بیمار استفاده می کند. بازبرنامه ریزی سلول ها به سلول های بنیادی و پیش ساز خون ساز(HSPCs) به یک امر موثر برای پیوند سلول های بنیادی اتولوگ به عنوان یک رویکرد درمانی برای برخی سرطان های خونی تبدیل شده است.
با این حال، مکانیسم هایی که این تبدیل شدن را تنظیم می کنند، در سطح مولکولی و سلولی به خوبی شناخته نشده اند. در مطالعه ای جدید، محققین دریافته اند که miR-223 یک ارتباط حیاتی بین قندهای پیچیده موسوم به گلیکان ها ها و گذار اندوتلیالی به هماتوپوئیتیکی(خون سازی، EHT) است؛ فرایندی که در آن اندوتلیوم خون ساز به سلول های بنیادی و پیش ساز خون ساز تمایز می یابد. با ترکیب زیست شناسی تحلیلی، ساختاری و سلولی، محققین دریافتند که پروتئین ها روی سطح سلول های اندوتلیالی بوسیله یک کد قندی خاص موسوم به ان-گلیکان مدیفه می شوند و همین امر تولید خون بوسیله آن ها را محدود می کند.
این زیست مولکول فعالیت تنظیم کننده های خون سازی را محدود می کند. این یافته می تواند دو کاربرد بالقوه داشته باشد: اول این که یک روش بهبود یافته را برای تولید سلول های بنیادی و با شانس موفقیت بیشتر ارائه می کند و دوم این که می تواند کاربرد گسترده ای در درمان سرطان داشته باشد و به محققین اجازه استفاده از مهندسی قندها برای تغییر سطح سلول ها و اثر گذاری روی پیشرفت سرطان را می دهد.
Reference:https://medicine.yale.edu/news-article/28757/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
پژوهشگران مرکز سرطان MUSC Hollings دریافته اند که بعد از پیوند سلول های بنیادی خون ساز، بلوک کردن مسیر انرژی جایگزین برای سلول های T می تواند به کاهش بیماری پیوند علیه میزبان(GvHD) در مدل های جانوری لوکمیا کمک کند. در این پژوهش جدید دکتر ژو ژانگ یو و همکارانش کشف کرده اند که سلول های T اهدایی برای القای GvHD باید دارای آنزیم کلیدی اسید لیپاز لیزوزومی باشند.
در این پژوهش آن ها روی درک تعادل زیستی بین GvHD و اثر پیوند علیه لوکمیا فوکوس کردند. پیوند سلول های بنیادی خون ساز به عنوان گزینه ای درمانی برای برخی از بیماران لوکمیایی استفاده می شود. سلول های T در گرافت سلول های بنیادی مشتق از اهدا کننده به بیماران لوکمیایی داده می شوند تا سلول های سرطانی را بکشند و سیستم ایمنی بیماران را مجددا بازسازی کنند. بیماری GvHD یک چالش بالینی بزرگ محسوب می شود زیرا سلول های T اهدایی که از مغز استخوان منشا می گیرند می توانند به اندام های بیماران حمله کنند.
معمولا 30 تا 70 درصد بیمارانی که متحمل پیوند مغز استخوان آلوژن می شود دچار GvHD می شوند و 15 درصد آن ها می میرند. هر سلول در بدن ما فرایند متابولیکی خودش را دارد ولی این متابولیسم معمولا طی بیماری های مختلف تغییر می کند. در مطالعه صورت گرفته در مرکز سرطان MUSC Hollings، محققین روی متابولیسم سلول های T فوکوس کردند تا تعادل بین GvHD و پاسخ های گرافت علیه لوکمیا را درک کنند. اغلب سلول های بدن برای تامین موثر انرژی به اکسیژن نیاز دارند.
با این حال، این مطالعه روی متابولیسم چربی فوکوس کرد. سلول های T دارای فرایندهای متابولیکی ویژه ای هستند و گاهی به دلیل تکثیر سریعی که دارند نیازمند استفاده از یک منبع انرژی اضافی در قالب اسیدهای چرب آزاد هستند. لیپاز اسید لیزوزومی آنزیمی است که لیپیدهای بزرگ و کلسترول را به اسیدهای چرب می شکند. اگر این آنزیم وجود نداشته باشد، اسیدهای چرب کافی برای تولید انرژی وجود ندارد. این تغییر متابولیسم سلول های T را تغییر می دهد که آن هم به نوبه خود موجب تغییر در عملکرد سلول های T می شود. در مطالعه روی مدل های موشی لوکمیا، محققین از مهار کننده لیپاز اسید لیزوزومی به نام اولیستات استفاده کردند(یک روز بعد از دریافت پیوند مغز استخوان). مهار آنزیم بوسیله این مهار کننده موجب کاهش قابل توجه GvHD در این موش ها شد. به عقیده محققین با انجام آزمایشات بیشتر می توان در آینده ای نزدیک از این استراتژی برای درمان GvHD انسانی استفاده کرد.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
محققین نشان داده اند که پروتئین BAHCC1 نقش حیاتی در خاموش سازی ژن ها بازی می کند و به عنوان یک جزء کلیدی برای مسیر سرکوب کننده ژن Polycomb در سلول های پستانداران عمل می کند. در سلول ها، مسیر Polycomb یک برچسب شیمیایی کوچک(H3K27me3) را برای خاموش کردن ژن ها تولید می کند. بازیگران مولکولی مرتبط با Polycomb و H3K27me3 به وفور یافت می شوند و با بیماری زایی و بویژه سرطان و سندرم های تکوینی مرتبط هستند. پیش از این محققین نشان داده بودند که BAHCC1 با سرطان و بویژه لوکمیا مرتبط هستند ولی در مورد آن اطلاعات اندکی در دسترس است. به عقیده آن ها مطالعه این پروتئین می تواند راهی مناسب برای درک اساسی نقش ژن Polycomb و خاموش سازی ژن باشد.
لوکمیا سرطانی است که خون و مغز استخوان را هدف قرار می دهد و سالانه بیش از 60 هزار نفر در آمریکا مبتلا به این سرطان تشخیص داده می شوند. در مطالعه جدید صورت گرفته در دانشگاه کارولینا محققین با تحلیل گذشته نگر داده های منتشر شده تاکنون بیان بالای ژن BAHCC1 را در انواع مختلف لوکمیا نشان دادند. با استفاده از فناوری ویرایش ژنومی CRISPR/Cas9 آن ها وابستگی مدل های مختلف لوکمیای حاد به BAHCC1 برای پیشرفت بیماری را نشان داده اند. آن ها نشان داده اند که BAHCC1 سرکوب کننده های توموری را مهار می کند تا موجب پیشرفت لوکمیا شود. این عملکرد BAHCC1 به توانایی آن برای اتصال به H3K27me3 بستگی دارد تا برخی از ژن ها خامو شوند. محققین پروتئین BAHCC1 و اتصال آن به H3K27me3 را هدف مناسبی برای مقابله با سرطان لوکمیا و طراحی داروها و درمان های جدید می دانند.
Reference: https://www.nature.com/articles/s41588-020-00729-3
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
در پژوهشی جدید محققین دانشگاه Duke تعدادی جهش "خاموش" را در حدود 30،000 حرف کد ژنتیکی ویروس شناسایی کرده اند که پس از جهش ویروس باعث رشد آن می شود و احتمالاً زمینه را برای همه گیری جهانی فراهم می کند. این تغییرات ظریف شامل چگونگی فولد شدن مولکول های RNA ویروس در سلولهای انسانی بود. در مطالعه ای که در مجله PeerJ منتشر شد، محققان از روشهای آماری برای شناسایی تغییرات سازگار در ژنوم SARS-CoV-2 در انسان استفاده کردند، اما اطلاعات به دست آمده خیلی شباهت به تغییرات موجود در ویروس کرونا خفاش ها نداشت .
نویسنده اصلی این مقاله در دانشگاه دوک گفت: "ما در تلاشیم بفهمیم چه چیزی این ویروس را منحصر به فرد کرده است." تحقیقات قبلی، ژنی را کشف نموده است که پروتئین هایSpike که روی سطح ویروس کرونا قرار دارند را رمزگذاری می کند، که این پروتئین ها نقش مهمی در توانایی آلوده سازی سلول های جدید دارند. مطالعه ذکر شده ترتیب جهش هایی را نشان داد که باعث تغییر پروتئین های Spike می شوند و حاکی از آن است که سویه های ویروسی حامل این جهش ها به احتمال زیاد قادر به رشد خواهند بود. محققان گزارش دادند که به نظر می رسد جهش های به اصطلاح خاموش در دو منطقه دیگر از ژنوم SARS-CoV-2 ، به نام های Nsp4 و Nsp16 وجود دارند. به نظر می رسد ویروس یک مرز بیولوژیکی نسبت به سویه های قبلی دارد بدون اینکه پروتئین های رمزگذاری شده آن تغییر کند. این تغییرات به جای تاثیر بر پروتئین ها، احتمالاً روی مواد ژنتیکی ویروس که از RNA ساخته شده است، اثر می گذارند که این مواد ژنتیکی شکل خاصی به خود گرفته و قادر باشند در داخل سلول های انسان عمل کنند.
Nsp4 و Nsp16 از جمله اولین مولکول های RNA هستند که با آلوده شدن فرد جدید به ویروس تولید می شوند. به طور کلی، با مشخص کردن تغییرات ژنتیکی که باعث رشد ویروس کرونا در میزبان های انسانی می شود، دانشمندان امیدوارند که شیوع بیماری مشترک انسان و سایر موجودات را پیش از وقوع بهتر پیش بینی کنند. ویروسها دائماً در حال جهش و تحول هستند. بنابراین ممکن است یک کرونا ویروس جدید که قادر به آلوده کردن حیوانات دیگر است نیز وجود داشته باشد که همچنان ممکن است مانند SARS-CoV-2 به مردم سرایت کند.
Reference: https://peerj.com/articles/10234/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
محققان نشان داده اند که پروتئین های کراتین در جنین اولیه و مرحله هشت سلولی جنین، نقش مهمی را در تنوع سلول به سلول بازی می کنند. در مرحله بلاستوسیستی، این ناهمگونی خودش را به صورت شبکه متراکمی از کراتین ها در تروفواکتودرم نشان می دهد و این با عدم بیان کراتین در توده داخلی سلولی(ICM) همراه است. تصویربرداری زنده با استفاده از mRNA کراتین نشان دار شده به صورت فلورسنت نشان دهنده سازمان دهی شدن فیلامنت های کراتین در ناحیه راسی سلول ها در مرحله اینترفاز است که منجر به توارث غیر متقارن فیلامنت های کراتین به سلول های دختری تبدیل شونده به تروفواکتودرم می شود. این در حالی است که سلول های دختری فاقد کراتین به نوعی درون روی می کنند و به سلول های توده داخلی تبدیل می شوند که در آینده لایه های جنینی و سلول های تخصص یافته جنین را تولید می کنند.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
به دنبال یک تحقیق مشترک بین مرکز تحقیقات سلولهای بنیادی دانشگاه واشنگتن و دانشگاه Rice پروژه ای طراحی شد تا در آن روشی برای کنترل میزان رشد بافت های مصنوعی ایجاد کنند.
در این مطالعه از مبدل و مسیرهای حرارتی برای تحریک فرایند رونویسی استفاده شد که از آن با نام (HEAT) یاد شده است. این پژوهش در مجله Science Advances به چاپ رسیده است.
بیش از 500 میلیون نفر در سراسر جهان از بیماری کبدی رنج می برند از این رو دانشمندان حوزه مهندسی بافت تلاش میکنند تا با تولید ارگان های مصنوعی، عملکردهای از دست رفته این بیماری ها را احیا کنند، با این وجود موانع زیادی وجود دارد که می بایست برطرف شوند.
این تیم در تحقیقات خود ، با به کارگیری یک سیستم گردش مایع در چاپگر سه بعدی، بستری را برای انتقال گرما به یک مکان خاص در داخل بافت فراهم نموده است تا بیان ژن های آن ناحیه را دستخوش تغییرات قرار دهد و شکلگیری سه بعدی ارگانی همچون کبد را تسهیلکند.
آخرین یافته های این تیم پژوهشی حاکی از آن است که استفاد از این تکنولوژی بواسطه فعال کردن مسیر سیگنالینگ WNT ، نقش بسیار مهمی در پایداری و رشد ارگان بازی میکند.همچنین محققان این پؤوژه معتقدند که این روش نه تنها برای تولید و رشد اندام میتواند مناسب باشد بلکه در ایجاد بستر مناسب برای پیوند اعضا نیز موثر است.
از نقایص این طرح که همچنان در حال بررسی برای ارتقا آن هستند، این است که دمای انتقال داده شده در مناطق مختلف می بایست کنترل شده اعمال شود، با این وجود محققین امیدوار اند که این روش جدید نشان دهد که چگونه الگوهای ژنتیکی میتواند بر روی تفکیک بافتها و عملکرد بخش های مختلف کبد اثر گذارد.
در نتیجه نویسنده مقاله اذعان داشت " روشHEAT به عنوان روشی نوین برای تنظیم بیان ژن در مقایسه با سایر ابزارهای همچون ترکیبات شیمیایی و یا استفاده از پرتو به حساب میآید." لذا پژوهشگران این مطالعه معتقدند که این روش میتواند نگرشی جدید را در حوزه مهندسی بافت ایجاد کند.
Link:https://www.regmednet.com/artificial-organ-growth-manipulated-by-novel-3d-printed-fluid-system/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
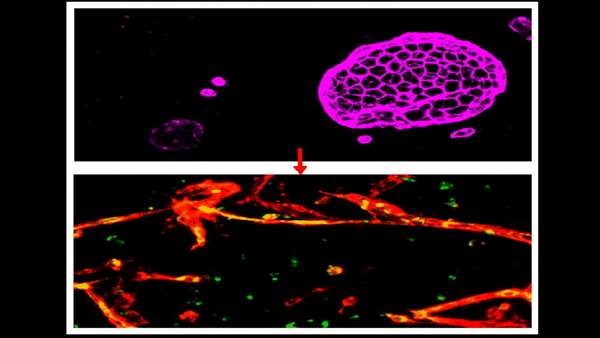
مطالعه سد خونی-مغزی در انسان مشکل است و استفاده از مدل های جانوری نیز به دلیل وجود تفاوت های فیزیولوژیک و آناتومیک متفاوت قابل اتکا نمی باشند. به همین دلیل دکتر دریتان آگالیو و همکارانش در دانشگاه ویل کورنل از پتانسیل سلول های بنیادی پرتوان القایی(iPSCs) برای تولید یک سد خونی-مغزی دارای عملکرد استفاده کرده اند.
آن ها این سلول های پرتوان را با استفاده از پروتکلی خاص به سلول های اندوتلیالی تمایز دادند که عروق خونی مغز و طناب نخاعی را مفروش می کنند و یک سد منحصربفرد را شکل می دهند که ورود مواد خطرناک، آنتی بادی ها و سلول های ایمنی از خون به مغز را مهار می کند. پروتکل تمایزی مورد استفاده بوسیله محققین منجر به بیان سه ژن در این سلولهای اندوتلیالی شده است که در نفوذ پذیری انتخابی شان نسبت به مواد مختلف و جلوگیری از عبور مواد خطرناک دخیل هستند. به همین دلیل این سلول ها می توانند برای مدل سازی سد خونی-مغزی استفاده شوند و از آن ها برای مطالعه بیماری های عصبی مربوط به اختلال سد خونی-مغزی و هم چنین غربالگری داروهای عصبی استفاده شود.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
مسیری نوین برای درمان بیماریها؛ با ژندرمانی آشنا شویم
حوزه پزشکی به کمک سلولهای بنیادی، متحول شده است و بسیاری از بیماریهای شکستناپذیر با تکیه به فناوریهای پیشرفته درمان میشوند.
فناوری ژن درمانی یا ژنتراپی یکی از روشهای نوآورانهای است که در معدودی از کشورهای پیشتاز در حوزه پزشکی به عنوان راهکاری اثربخش برای درمان بیماریهای صعبالعلاج به کار میبرند. این نوع درمان، یک روش تجربی است که از ژن برای درمان یا پیشگیری از بیماری استفاده می کند.
در آیندهای نه چندان دور، این روش ممکن است به پزشکان اجازه دهد تا به جای استفاده از دارو یا جراحی، با قرار دادن یک ژن در سلولهای بیمار، یک اختلال را درمان کنند. محققان چندین روش برای ژن درمانی را آزمایش می کنند.
اگرچه ژن درمانی یک گزینه درمانی امیدوار کننده برای تعدادی از بیماری ها، از جمله اختلالات ارثی، برخی از انواع سرطان و برخی از عفونت های ویروسی است. اما این روش همچنان در حال توسعه و آزمایشهای بیشتری است و برای اطمینان از ایمن و موثر بودن آن پژوهشهای متعددی در حال انجام هنوز در دست مطالعه است. ژن درمانی در حال حاضر فقط برای بیماریهایی که هیچ درمان دیگری ندارند استفاده می شود.
افقهای پیش روی ژن درمانی
ژن درمانی توسط پژوهشگران در دست بررسی است تا مشخص شود آیا میتواند برای درمان بیماریها مورد استفاده قرار گیرد. تحقیقات فعلی ارزیابی ایمنی ژن درمانی را مورد بررسی قرار دادهاند و درباره اینکه ژن درمانی بر روی درمان چه بیماریهایی مؤثر است، تحقیق کردهاند.
قوانین، مقررات و دستورالعمل های جامع برای پیاده سازی روشهای مبتنی بر ژن درمانی وجود دارد و محققانی که قصد دارند از این روش در یک کارآزمایی بالینی استفاده کنند، میبایست با استفاده از این دستورالعملها کار پژوهشی خود را پیش ببرند.
قبل از انجام هر آزمایش بالینی ژن درمانی، باید این روش به لحاظ ایمنی زیستی تأیید شود تا خطرناک بودن یک پژوهش برای سلامت مورد بررسی و آن روش مورد تایید قرار بگیرد.
با توجه به اهمیت و کاربردهای روزافزون روشهای ژن درمانی در پزشکی، شرکتهای دانشبنیان و پژوهشگاههای فعال در حوزه سلولهای بنیادی، در مسیر فناوریهای ژن درمانی گام برداشته است. در حال حاضر مجموعه اختصاصی تولید فرآوردههای ژن درمانی با استانداردهای جهانی در کشور ارائه میشود.
مرکز تولید فرآورده های ژن درمانی سوئیت تولید، با قابلیت فراوری وکتورهای انتقال ژن ویروسی و سلول های دست ورزی شده با این وکتورها یکی از دستاوردهای کشور در پژوهشگاه رویان برای فعالیت در حوزه ژن، همچنین اتاقهایی برای بانک های وکتور و سلول و نیز انبار و آماده سازی مواد اولیه در نظر گرفته شده است. کلیه استانداردهای GMP در طراحی و ساخت این مجموعه در نظر گرفته شده است.
در کشورمان نیز پژوهشها و محصولات دانشبنیان در حوزه ژن درمانی و سلول درمانی در مسیر توسعه و پیشرفت قرار دارد و دستاوردهای ارزشمند در این حوزه به دست آمده است.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
امروزه استفاده از سلول های بنیادی خونساز به عنوان یک راهکار درمانی مناسب، دامنه وسیعی از سرطانهای صعب العلاج، بیماریهای خونی، ژنتیکی و خودایمنی را پوشش میدهد. اما متاسفانه تعداد این سلول های بنیادی در مغز استخوان یک فرد بالغ، 1 به ازای 2500 سلول خونی می باشد. در این مطالعه بیوانفورماتیکی، محققان با گسترش یک الگوریتم به نام VIPER، موفق به کشف پروتئینی شدند که در باز برنامه نویسی سلول های بنیادی خونساز نقش ایفا میکنند.
این الگوریتم موفق به شناسایی پروتئین کد شaونده ای از ژن BAZ2B شد، که نقش بسیار تاثیر گذاری در تقسیم و افزایش تعداد سلول های بنیادی خونساز درخون بند ناف ایفا میکند. این ژن با حضور در چندین مسیر زیستی، موجب فعال سازی مناطقی از ژنوم می شود که تا قبل از آن در سلول تمایز یافته غیر قابل دسترس بوده است.
لذا موجب بازگردانی سلولهای خونی تمایز یافته به سلول های بنیادی خونساز می شود. در این مطالعه به منظور نشان دادن زنده مانی و حفظ قدرت تقسیم و تمایز سلول های بنیادی حاصل از سلول های تمایز یافته، سلول های حاصل شده به یک موش مدل پیوند زده شد و نتایج آن گزارش گردید. قابل ذکر است که الگوریتم VIPER نه تنها در این مطالعه بلکه پتانسیل بررسی سایر پروتئین های حیاتی در رشد و تقسیم و تمایز سلول های بنیادی را دارا می باشد.
References: https://phys.org/news/2020-12-method-boost-life-saving-stem-cells.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
سلول های بنیادی مشتق از چربی می توانند به بیماران مبتلا به زخم پای دیابتی غیر قابل بهبود کمک کنند
در پروژه ای مشترک تیمی از انستیتوی پزشکی ایالات متحده آمریکا با محققان دانشگاه ملی نیکاراگوئه آزمایشی را طراحی نمودند که در آن به بررسی تاثیر استفاده از سلولهای بنیادی و SVF استخراج شده از بافت چربی، بر روی زخم های دیابتی پرداختند.
نتایج مطالعه فاز I ، منتشر شده در Stem Cells Translational Medicine ، نشان داد که SVF استخراج شده می توانند تشکیل عروق خونی را القا کنند و ترمیم زخم را تسریع کنند.
مایکل کارستنز (از محققین این پروژه) توضیح داد: "درمان بیماریهای عروقی و زخم های مزمن به دلیل بیماری عروق سطحی و یا دیابت، در کشورهای فقیرنشین مانند نیکاراگوئه دشوار است."
وی گفت: "بیماران برای دریافت مراقبت های پزشکی معمولاً مجبورند مسافت طولانی را در شرایط نامناسب جاده طی کنند. پیوند عروق برای اکثر مردم از نظر اقتصادی امکان پذیر نیست و روشهای پیشرفته تر همچون استفاده از سلولهای بنیادی که به امکانات پردازش سلول نیاز دارند چالشهای قابل توجهی از نظر لجستیکی و اقتصادی به دنبال دارد. در چنین شرایطی، زخم های ایسکمیک غیرقابل ترمیم، بیماران و پزشکان را با گزینه های ناخوشایندی همچون: درد مزمن و خطر عفونت یا قطع عضو مواجه می کند. "
در این مطالعه 63 فرد در سنین 35 تا 70 سال که مبتلا به دیابت نوع 2 و زخم پای دیابتی مزمن بودند، داوطلب شدند بطوریکه همه شرکت کنندگان کاندیدای قطع اندام بودند.
در ابتدا با استخراج چربی از خود بیماران و استخراج SVF ، به خود آن ها تزریق نمودند. این تزریق در بستر زخم ، اطراف محیط و در امتداد شریان های پا (dorsalis pedis و tibialis poserior) انجام گردید.
ارزیابی پیگیری از زخمهای دیابتی در فواصل 6 و 12 ماه انجام شد. پس از 12 ماه ، 50 نفر از شرکت کنندگان 100٪ بهبود زخم داشتند در حالی که چهار نفر بهبودی بیش از 85٪ داشتند.
کارستن ادامه داد: "روند بهبودی همانطور که انتظار می رفت در دو جهت مختلف مشاهده شد: از حاشیه و رو به قسمت داخلی از بستر زخم انجام شد." "در چندین مورد ، بافت تازه توسعه یافته قادر به پوشاندن تاندون هایی شد که سابقا در معرض دید بود. بعلاوه ، حتی در بین زخمهای بزرگتر از 10 سانتی متر مربع نیز عملاً کلیه بیماران در 6 ماهگی 85٪ بهبودی به دنبال داشتند. اما هیچ ارتباطی بین اندازه و بسته شدن زخم مشاهده نشد. "
در نهایت محققان امیدوارند که پس از بررسی های بالینی بیشتر ، تزریق SVF به یک درمان ایمن و موثر برای زخم های پای دیابتی تبدیل شود و از تحلیل رفتن اندام جلوگیری کند.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

در مطالعه ای جدید محققین با استفاده از سلول های بنیادی پرتوان القایی(iPSCs)، سلول های مغزی شامل نورون ها و آستروسیت ها را تولید کرند و در ادامه آن ها را با SARS-CoV-2 آلوده کردند و مشاهده کردند که هر دو نوع سلول به آلودگی مستعد بودند. در ادامه از این سلول های iPS برای تولید ارگانوئیدهای مغزی استفاده شد که یکی از آن ها دارای آستروسیت و دیگری فاقد آستروسیت بودند. بررسی ها نشان داد که ارگانوئیدهای دارای آستروسیت آلودگی بسیار شدیدتری را نسبت به SARS-CoV-2 نشان دادند.
در بخش بعدی مطالعه محققین سعی در بررسی اثر ApoE4 روی حساسیت به SARS-CoV-2 داشتند و آن ها نورون ها و آستروسیت هایی را از iPSCs مشتق از بیماران مبتلا به آلزایمر و دارای ApoE4 تولید کردند. نتایج نشان داد که نورون ها و آستروسیت های ApoE4 هر دو شدیدا به SARS-CoV-2 حساس هستند و میزان آسیب به این نورون ها در مقایسه با نورون های طبیعی و نورون های ApoE3 به مراتب بیشتر بود.
در بخش انتهایی مطالعه، محققین داروی ضد ویروسی remdesvir را برای مهار آلودگی ویروسی در نورون ها و آستروسیت ها تست کردند و مشاهده کردند که این دارو با موفقیت سطح آلودگی ویروسی را در آستروسیت ها کاهش داد و مانع از مرگ سلولی شد. هم چنین تخریب نورون ها را نیز مهار کرد.
به عقیده محققین افزایش دانسته ها در مورد COVID-19 می تواند راهگشای ایجاد راهکارهای درمانی بیشتر برای این بیماری همه گیر باشد.
https://medicalxpress.com/news/2021-02-explore-link-alzheimer-gene-covid-.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
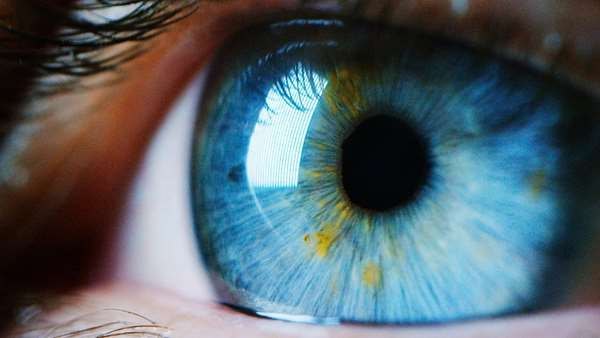
تصور احیای بینایی بیمارانی که به دلیل آسیب عصب بینایی دچار نابینایی شده اند تا چند سال پیش چیزی شبیه یک رویا و افسانه بود. اما از زمان کشف سلول های بنیادی، امیدواری برای درمانی این مشکل زیاد شده است. چشم انسان دارای بیش از یک میلیون سلول عصبی کوچک موسوم به سلول های گانگلیونی شبکیه است که در انتقال نور از گیرنده های نوری به مغز نقش دارند.
این سلول ها دارای آکسون هایی هستند که با یکدیگر یکی شده و عصب بینایی را بوجود می آورند. زمانی که در بیماری گلوکوم فشار چشم افزایش می یابد، این امر موجب آسیب به این سلول ها و مردن آن ها می شود و همین امر منجر به نابینایی می شود. در پژوهشی جدید در دانشگاه جان هاپکینز، دکتر جانسون و همکارانش شبکیه های موشی را در آزمایشگاه تولید کردند و در ادامه آن چه بعد از اضافه کردن سلول های گانگلیون شبکیه انسانی مشتق از سلول های بنیادی جنینی به سطح این شبکیه ها اتفاق می افتد را مونیتور کردند.
آن ها مشاهده کردند که اغلب سلول های انسانی پیوند شده قادر به تلفیق شدن به بافت شبکیه ای که دارای چندین لایه سلولی بود نشدند. در ادامه آن برش های میکرومتری و دقیقی را روی سطح شبکیه ایجاد کردند و مشاهده کردند که سلول های پیوند شده از این بخش خزیده و به درون شبکیه نفوذ کرده و با شبکیه تلفیق می شوند. با دید گرفتن از این فرایند، در ادامه آن ها از یک آنزیم استفاده کردند که موجب سست شدن فیبرهای پیوندی غشای سطح چشم شد و به این ترتیب سلول های پیوند شده با الگویی طبیعی با شبکیه تلفیق شدند و رفته رفته ارتباطات عصبی مناسبی را با سایر بخش های شبکیه برقرار کردند. این یافته ها نشان می دهد که تغییر غشای پوشاننده شبکیه می تواند گامی ضروری و مهم برای رشد مجدد سلول های پیوند در شبکیه آسیب دیده باشد.
https://www.cell.com/stem-cell-reports/fulltext/S2213-6711(20)30495-1?
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
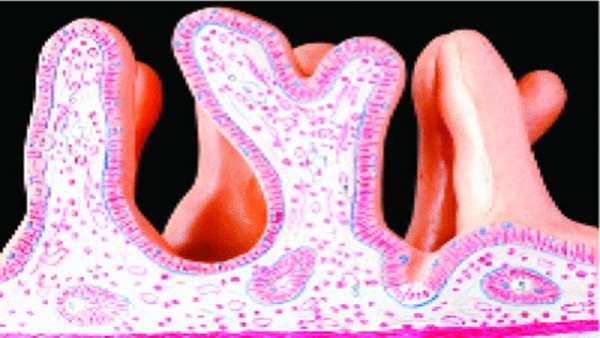
انتروسیت ها که اپی تلیوم روده کوچک را می پوشانند، جایگاه جذب و متابولیسم اغلب داروهایی هستند که به صورت خوراکی مصرف می شوند. به همین دلیل، مطالعه روی جذب داروهای خوراکی به مدل های آزمایشگاهی و جانوری متکی است که بتوانند محیط روده کوچک را به خوبی شبیه سازی کنند.
در حال حاضر، محققین به طور گسترده ای از رده سلول سرطان کولون انسانی Caco-2 به عنوان مدلی برای اپی تلیوم روده استفاده می کنند. با این حال، این امر خود معایبی دارد زیرا Caco-2 مربوط به کولون می باشد و در نتیجه نمی توان نتایج مربوط به آن را به روده کوچک نسبت داد. برای مثال این سلول ها سیتوکروم P450 3A4 یا CYP3A4 که برای متابولیسم داروها حیاتی است را بیان نمی کنند و این سیتوکروم در روده کوچک به وفور بیان می شود.
برای حل این مشکل، محققین ژاپنی در دانشگاه توکیو سلول های شبه انتروسیتی را از سلول های بنیادی پرتوان القایی تولید کرده اند. آن ها توانسته اند با شبیه سازی مراحل اولیه جنینی، سلول های پیش ساز روده کوچک را تولید کنند. در ادامه این سلول ها روی یک غشای ویتری ژل کلاژن(CVM) کشت داده شدند و با محیط حاوی 6-بروموایندیروبین-3-اکسیم، دی متیل سولفوکساید، دگزامتازون و ویتامین D3 فعال شده تیمار شدند. نتیجه تلاش آن ها تولید سلول های شبه انتروسیتی بود که دقیقا شبیه انتروسیت های واقعی بودند و پروتئین های ترانسپورتر دخیل در جذب دارو و هم چنین سیتوکروم CYP3A4 را بیان می کردند. به عقیده محققین تولید این سلول های شبه انتروسیتی می تواند گام مهم و بزرگی در جهت غربالگری داروهای روده ای باشد.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

دانشمندی که در چندجبهه میجنگد/تمایزهای دانشمند مسلمان و سکولار
کتاب «سلولهای بهاری»؛ خاطرات تولید و توسعه سلولهای بنیادی به روایت حسین بهاروند، پدر دانش سلولهای بنیادی ایران است که به تازگی توسط انتشارات «راه یار» منتشر شده است.
بهاروند، استاد ممتاز و مؤسس پژوهشکده زیستشناسی و فناوری سلولهای بنیادی پژوهشگاه رویان، در سال ۱۳۷۶ به پژوهشگاه رویان پیوست و پس از چند سال پژوهش، در سال ۱۳۸۲ توانست برای اولین بار در ایران سلولهای بنیادی رویانی انسانی را تولید کند. او در سال ۱۳۸۷ نیز به همراه همکارانش موفق به تولید سلولهای بنیادی پرتوان القائی انسانی شد. اینفعالیتها او و همکارانش را قادر ساخت تا شاخههای مختلف پزشکی بازساختی را در ایران پایهگذاری کنند.
وی تاکنون بیش از سیجایزه ملی و بینالمللی از جمله جایزه رازی، خوارزمی، آیسسکو، آکادمی علوم جهان (TWAS)، یونسکو و جایزه مصطفی(نشان عالی علموفناوری جهان اسلام) دریافت کرده است.
زندگی دکتر حسین بهاروند به خودی خود آنقدر دارای لحظات جذاب و پر از فراز و نشیب هست که برای خواندن جذابیت داشته باشد این جذابیت در کنار نثر روان و قابل فهم و در عین حال ادبیات شخص راوی(دکتر بهاروند) سلولهای بهاری را اثری قابل قبول و دفاع نموده است.
خستگیناپذیری از آن دست صفاتی است که به عمقش کمتر توجه میشود. این صفت خودش را در شرایط سخت و با وجود موانع جدی و متعدد عیان میسازد. یکی از صفات غیرقابل انکار در شخصیت دکتر بهاروند همین خستگیناپذیری اوست. کتاب «سلولهای بهاری» در تبیین این صفت در شخصیت سوژه اصلی کاملا موفق بوده است. محقق ایرانی باید همزمان در چند جبهه بجنگد.
آنچه محقق ایرانی و شیعی را دارای هویت مستقل و ویژه میکند پیوند علم به معنای science و معارف حقه الهی است. دانشمند سکولار خودش است و جهان طبیعت. اما دانشمند شیعه خودش است و طبیعت و خالق این طبیعت از اینرو در جنگ و تلاش هر روزهاش برای کشف قواعد جهان دائما تکیه و نگاه به خالق آن دارد. در این مسیر هر روزه از او یاری میخواهد.
در مجموع مطالعه این اثر برای نوجوانانی که در آستانه ورود به دانشگاه هستند، برای همه دانشجویان ایرانی در همه سطوح و برای همه مردان و زنانی که به ایران و ایرانی با دیده شک و ناباوری مینگرند و برای همه آنانی که دل در گرو میهن دارند نه تنها لازم و مفید که واجب است.
دانش-آموزان-آلاء
اینجا

 میتونی بیشتر دکتر بهاروند بشناسی
میتونی بیشتر دکتر بهاروند بشناسی
https://forum.alaatv.com/post/1476792
https://forum.alaatv.com/post/1476790
https://forum.alaatv.com/post/1476788
https://forum.alaatv.com/post/1476786
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
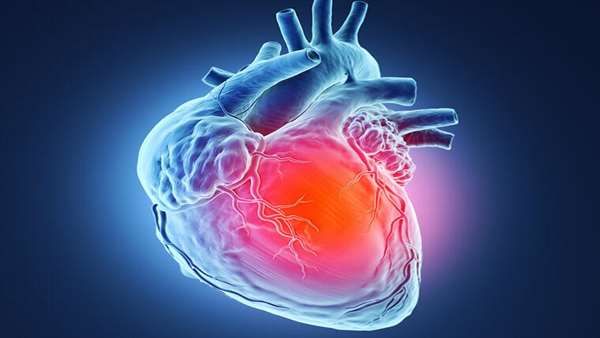
دانشمندان در موسسه تحقیقات پزشکی mount sinani آمریکا نشان داده اند که دسته ای از سلول های بنیادی مشتق شده از جفت که تحت عنوان سلول های cdx2 مثبت شناخته می شوند، می توانند سلول های قلبی را پس از حمله قلبی در مدل های حیوانی کاملا بازسازی کنند. تا قبل از این به نظر می رسید که سلول های cdx2 تنها مسئول تولید جفت در مراحل ابتدایی تکوین جنین هستند و توانایی بازسازی سایر ارگان ها را ندارند.
نتایج حاصل از این آزمایش بسیار شگفت انگیز و خیره کننده بود زیرا در هیچ یک از آزمایشات بالینی که تا به حال بر روی درمان های قلبی انسان صورت گرفته، هیچ نوع سلول دیگری در پتری دیش به صورت سلول های قلبی دارای ضربان نبوده است و نکته جالب این بود زمانیکه این سلول ها به جریان خون تزریق می شدند به طرز هوشمندانه ای می دانستند که باید به کجا روند! این نتایج می تواند مسیر پزشکی بازساختی ارگان های دیگر را نیز هموار کند.
https://www.pnas.org/content/116/24/11786
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
گروهی از محققین پروتئین ویژه ای را کشف کردند که در تقسیم و رشد سلول های بنیادی خونساز نقش ویژه ای دارد. پژوهش آن ها در مجله Cell Reports به چاپ رسید که بیانگر توسعه روشی جدید برای رشد و تکثیر این سلولها، چه در محیط داخل بدن و چه در محیط آزمایشگاهی در مقایس زیاد تولید بشوند.
امروزه استفاده از سلول های بنیادی خونساز به عنوان یک راهکار درمانی مناسب، دامنه وسیعی از سرطانهای صعب العلاج، بیماریهای خونی، ژنتیکی و خودایمنی را پوشش میدهد. اما متاسفانه تعداد این سلول های بنیادی در مغز استخوان یک فرد بالغ، 1 به ازای 2500 سلول خونی می باشد.
در این مطالعه بیوانفورماتیکی، محققان با گسترش یک الگوریتم به نام VIPER، موفق به کشف پروتئینی شدند که در باز برنامه نویسی (Reprogramming) سلول های بنیادی خونساز نقش ایفا میکنند. این الگوریتم موفق به شناسایی پروتئین کد شونده ای از ژن BAZ2B شد، که نقش بسیار تاثیر گذاری در تقسیم و افزایش تعداد سلول های بنیادی خونساز درخون بند ناف ایفا میکند. این ژن با حضور در چندین مسیر زیستی، موجب فعال سازی مناطقی از ژنوم می شود که تا قبل از آن در سلول تمایز یافته غیر قابل دسترس بوده است.لذا موجب بازگردانی سلولهای خونی تمایز یافته به سلول های بنیادی خونساز می شود. در این مطالعه به منظور نشان دادن زنده مانی و حفظ قدرت تقسیم و تمایز سلول های بنیادی حاصل از سلول های تمایز یافته، سلول های حاصل شده به یک موش مدل پیوند زده شد و نتایج آن گزارش گردید.
قابل ذکر است که الگوریتم VIPER نه تنها در این مطالعه بلکه پتانسیل بررسی سایر پروتئین های حیاتی در رشد و تقسیم و تمایز سلول های بنیادی را دارا می باشد.
Link: https://www.regmednet.com/cell-to-cell-fusion-approach-boosts-supply-of-blood-stem-cells/
--
اینجا
 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470









 🧫
🧫