سلول های بنیادی راهی به آینده
-
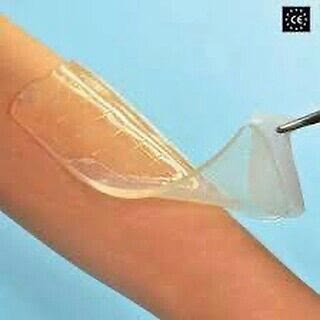
نوعی هیدروژل جدید برای بهبود زخم های پوستی(2)
یکی از پلیمرهای طبیعی مورد استفاده در ساخت هیدروژل ها آلژینات است که یک ترکیب مشتق از جلبک های دریایی است. در ساخت هیدروژل ها از آلژینات مشکلاتی مانند ژل شدن سریع این پلیمر وجود دارد که کنترل کردن آن را مشکل می سازد و هم چنین محیط این هیدروژل معمول مقداری اسیدی و با PH 4 تا 6 و یا طبیعی است که این محیط اسیدی برای بهبودی زخم سودمند است. اما پژوهش صورت گرفته به وسیله تشیما و همکارانش نشان می دهد که PH تا حدی قلیایی(8 تا 5/8) می تواند بهبودی زخم بوسیله سلول هایی مانند فیبروبلاست ها و کراتینوسیت ها را افزایش دهد. آن ها یک هیدروژل آلژیناتی دارای pH قلیایی را بدون استفاده از ابزاری خاص و در دمای اتاق تولید کرده اند. از آن جایی که هیدروژل ظرف مدت کمتر از 5 دقیقه شکل می گیرد می توانند زخم پوشی بسیار ایده آل برای استفاده در جاهایی باشد که بهبود سریع زخم از اولویت برخوردار است. این روش شامل مخلوط کردن کربنات کلسیم و آلژینات پتاسیم و سپس اضافه کردن آب کربنه به این مخلوط و اجازه دادن به آن برای ژل شدن است. در این روشpH ژل به سمت قلیایی شدن می رود زیرا دی اکسید کربن بعد از ژلاتینه شدن تبخیر می شود. این ژل، ژلی شفاف خواهد بود که اجازه مونیتور کردن روند ترمیم زخم را نیز می دهد و تا 99 درصد آب جذب می کند. این هیدروژل به خوبی اگزودای زخم را جذب می کند و به خوبی می تواند بعد از بهبودی زخم برداشته شود.
این روش شامل مخلوط کردن کربنات کلسیم و آلژینات پتاسیم و سپس اضافه کردن آب کربنه به این مخلوط و اجازه دادن به آن برای ژل شدن است. در این روشpH ژل به سمت قلیایی شدن می رود زیرا دی اکسید کربن بعد از ژلاتینه شدن تبخیر می شود. این ژل، ژلی شفاف خواهد بود که اجازه مونیتور کردن روند ترمیم زخم را نیز می دهد و تا 99 درصد آب جذب می کند. این هیدروژل به خوبی اگزودای زخم را جذب می کند و به خوبی می تواند بعد از بهبودی زخم برداشته شود. Reference: https://infomeddnews.com/hydrogel-wound-healing/
Reference: https://infomeddnews.com/hydrogel-wound-healing/
@دانش-آموزان-آلاء
Zaraa -
 محققان سلول های بنیادی را برای تبدیل شدن به سلول های هر سه لایه جنینی تحریک کردند و با غوطه ور کردن آن ها در محیط حاوی مواد غذایی و فاکتورهای رشد موجب خود سازماندهی آن ها به ساختارهای شبه جنینی شدند. در ادامه این جنین های مصنوعی به رحم موش های ماده منتقل کردند و تنها 7 درصد آن ها قادر به لانه گزینی موفقیت آمیز شد. یک هفته بعد جنین های ایمپلنت شده با موفقیت از طریق سزارین برداشته شدند. ارزیابی های میکروسکوپی نشان داد که ساختارهای جنینی اولیه در این جنین ها شکل گرفتند اما دارای ناهنجاری های قابل توجهی بودند. این ساختار و سازماندهی بافتی به اندازه جنین های طبیعی خوب نبود. این مطالعه برای اولین بار نشان داد که جنین های مصنوعی می توانند در بافت های جنینی در رحم شروع به تکوین کنند. گروه هایی هم پیش از این توانسته بودند جنین های موشی مصنوعی را تولید کنند اما آن ها قادر به ایمپلنت شدن موفقیت آمیز نبودند. شاید موفقیت این مطالعه به دلیل رشد جنین ها درون مخلوطی از مواد غذایی و فاکتورهای رشد شبیه با محیط طبیعی رشد جنین ها باشد. به عقیده محققین تولید این جنین های مصنوعی و تکوین آن ها در رحم به محققین اجازه می دهد تا تکوین واقعی آن ها را به خوبی تقلید کنند و مورد مطالعه قرار دهند. هم چنین این جنین های مصنوعی می توانند برای مطالعه مشکلات مربوط به باروری در آینده نیز مورد استفاده قرار گیرند.
محققان سلول های بنیادی را برای تبدیل شدن به سلول های هر سه لایه جنینی تحریک کردند و با غوطه ور کردن آن ها در محیط حاوی مواد غذایی و فاکتورهای رشد موجب خود سازماندهی آن ها به ساختارهای شبه جنینی شدند. در ادامه این جنین های مصنوعی به رحم موش های ماده منتقل کردند و تنها 7 درصد آن ها قادر به لانه گزینی موفقیت آمیز شد. یک هفته بعد جنین های ایمپلنت شده با موفقیت از طریق سزارین برداشته شدند. ارزیابی های میکروسکوپی نشان داد که ساختارهای جنینی اولیه در این جنین ها شکل گرفتند اما دارای ناهنجاری های قابل توجهی بودند. این ساختار و سازماندهی بافتی به اندازه جنین های طبیعی خوب نبود. این مطالعه برای اولین بار نشان داد که جنین های مصنوعی می توانند در بافت های جنینی در رحم شروع به تکوین کنند. گروه هایی هم پیش از این توانسته بودند جنین های موشی مصنوعی را تولید کنند اما آن ها قادر به ایمپلنت شدن موفقیت آمیز نبودند. شاید موفقیت این مطالعه به دلیل رشد جنین ها درون مخلوطی از مواد غذایی و فاکتورهای رشد شبیه با محیط طبیعی رشد جنین ها باشد. به عقیده محققین تولید این جنین های مصنوعی و تکوین آن ها در رحم به محققین اجازه می دهد تا تکوین واقعی آن ها را به خوبی تقلید کنند و مورد مطالعه قرار دهند. هم چنین این جنین های مصنوعی می توانند برای مطالعه مشکلات مربوط به باروری در آینده نیز مورد استفاده قرار گیرند. Reference: https://linkinghub.elsevier.com/retrieve/pii/S0092867419310803
Reference: https://linkinghub.elsevier.com/retrieve/pii/S0092867419310803 -

#اخبار_جدید_سلولهای_بنیادی
 تولید سلول های ایمنی در آزمایشگاه
تولید سلول های ایمنی در آزمایشگاه محققان در مطالعه ای نشان داده اند که چگونه اولین ترین سلول های ایمنی در بدن شکل می گیرند. این سلول های ایمنی که از نوع لنفوسیت ها هستند بوسیله سلول هایی شکل می گیرند اولین اندام های جنین را تولید می کنند و این بدین معنی است که آن ها حاصل سلول های بنیادی خون ساز موجود در مغز استخوان نیستند. در این پژوهش، محققین از ترکیبی از دو فناوری آزمایشگاهی قوی به نام های مهندسی ژنتیک و کشت سلول های بنیادی در شرایط آزمایشگاهی استفاده کردند. در ابتدا آن ها آن ها سلول های بنیادی پرتوان مهندسی شده ای را تولید کردند که زمانی که یک مارکر پروتئینی مختص سلول های ایمنی اولیه به نام RAG1 روشن می شود، به رنگ سبز درخشان در می آیند. پروتئین RAG1 را مسئول ایجاد پاسخ ایمنی به عفونت ها و واکسن ها می دانند. در ادامه محققین سلول های RAG1 مثبت را جداسازی کردند و نشان دادند که آن ها می توانند به انواع متعدد سلول های ایمنی از جمله سلول های مورد نیاز برای تکوین کل سیستم ایمنی تبدیل شوند. به عقیده محققین، این سلول های اولیه برای بلوغ صحیح تیموس به عنوان اندامی که مسئول تولید سلول های T است، ضروری هستند. سلول های RAG1 مثبت، محیطی ایمن و مطمئن را برای سلول های ایمنی که بعدا تولید می شوند، ارائه می کنند.
محققان در مطالعه ای نشان داده اند که چگونه اولین ترین سلول های ایمنی در بدن شکل می گیرند. این سلول های ایمنی که از نوع لنفوسیت ها هستند بوسیله سلول هایی شکل می گیرند اولین اندام های جنین را تولید می کنند و این بدین معنی است که آن ها حاصل سلول های بنیادی خون ساز موجود در مغز استخوان نیستند. در این پژوهش، محققین از ترکیبی از دو فناوری آزمایشگاهی قوی به نام های مهندسی ژنتیک و کشت سلول های بنیادی در شرایط آزمایشگاهی استفاده کردند. در ابتدا آن ها آن ها سلول های بنیادی پرتوان مهندسی شده ای را تولید کردند که زمانی که یک مارکر پروتئینی مختص سلول های ایمنی اولیه به نام RAG1 روشن می شود، به رنگ سبز درخشان در می آیند. پروتئین RAG1 را مسئول ایجاد پاسخ ایمنی به عفونت ها و واکسن ها می دانند. در ادامه محققین سلول های RAG1 مثبت را جداسازی کردند و نشان دادند که آن ها می توانند به انواع متعدد سلول های ایمنی از جمله سلول های مورد نیاز برای تکوین کل سیستم ایمنی تبدیل شوند. به عقیده محققین، این سلول های اولیه برای بلوغ صحیح تیموس به عنوان اندامی که مسئول تولید سلول های T است، ضروری هستند. سلول های RAG1 مثبت، محیطی ایمن و مطمئن را برای سلول های ایمنی که بعدا تولید می شوند، ارائه می کنند.
 Reference: https://www.nature.com/articles/s41556-019-0445-8
Reference: https://www.nature.com/articles/s41556-019-0445-8 -

 راهکار محققان برای بهینه سازی شبکیه های مصنوعی
راهکار محققان برای بهینه سازی شبکیه های مصنوعی شبکیه مصنوعی، به یک تراشه رایانهای بسیار کوچک و الکترودهای فلزی نیاز دارد. این الکترودها ابتدا فعالیت نورونهای اطراف خود را ثبت میکنند تا نقشهای از انواع سلول ارائه دهند. این اطلاعات در مرحله بعد، برای انتقال دادههای تصویری از دوربین به مغز مورد استفاده قرار میگیرند. یکی از مشکلات این است که دادههای منتقل شده توسط چشم بسیار زیاد هستند؛ تا جایی که ممکن است به داغ شدن تجهیزات الکترونیکی منجر شوند. ای. جی چیچیلنیسکی استاد دانشگاه استنفورد و از اعضای این گروه پژوهشی گفت: تراشههای مورد نیاز برای ساخت یک شبکیه مصنوعی با کیفیت بالا، میتوانند به داغ شدن بافتی منجر شوند که به آن وارد شدهاند. پژوهشگران روشی ابداع کردند تا این مشکل را با کمک دادههای تصویری که نورونها در چشم به وجود میآورند، حل کنند.
شبکیه مصنوعی، به یک تراشه رایانهای بسیار کوچک و الکترودهای فلزی نیاز دارد. این الکترودها ابتدا فعالیت نورونهای اطراف خود را ثبت میکنند تا نقشهای از انواع سلول ارائه دهند. این اطلاعات در مرحله بعد، برای انتقال دادههای تصویری از دوربین به مغز مورد استفاده قرار میگیرند. یکی از مشکلات این است که دادههای منتقل شده توسط چشم بسیار زیاد هستند؛ تا جایی که ممکن است به داغ شدن تجهیزات الکترونیکی منجر شوند. ای. جی چیچیلنیسکی استاد دانشگاه استنفورد و از اعضای این گروه پژوهشی گفت: تراشههای مورد نیاز برای ساخت یک شبکیه مصنوعی با کیفیت بالا، میتوانند به داغ شدن بافتی منجر شوند که به آن وارد شدهاند. پژوهشگران روشی ابداع کردند تا این مشکل را با کمک دادههای تصویری که نورونها در چشم به وجود میآورند، حل کنند. نورونهای شبکیه برای انتقال اطلاعات تصویری، پالسهای الکتریکی را به مغز میفرستند. مشکل اینجاست که شبکیه دیجیتالی برای درک ویژگی نورونها، باید این پالسها را ثبت و رمزگذاری کند اما در این فرآیند، گرمای زیادی تولید میشود. نخستین شبکیه دیجیتالی واقعی، به دهها هزار الکترود نیاز دارد که موجب میشوند این فرآیند، پیچیدهتر شود. بوریس مورمان، استاد مهندسی برق دانشگاه استنفورد گفت: ما روشی پیدا کردیم تا بتوانیم سطح درک تصویری را با استفاده از دادههای کمتری انجام دهیم. ما با درک بهتر توانستیم میزان دادههایی که باید پردازش شوند، کاهش دهیم. ما موفق شدیم با انتخاب دادهها، نمونههای اساسی و انتخاب دیجیتالی پالسهای منحصر به فرد، از میزان دادهها کم کنیم. وی افزود: پیش از این، مراحل دیجیتالسازی و فشردهسازی، به صورت جداگانه صورت میگرفتند و دادههای اضافی بسیاری را ذخیره و منتقل میکردند.
نورونهای شبکیه برای انتقال اطلاعات تصویری، پالسهای الکتریکی را به مغز میفرستند. مشکل اینجاست که شبکیه دیجیتالی برای درک ویژگی نورونها، باید این پالسها را ثبت و رمزگذاری کند اما در این فرآیند، گرمای زیادی تولید میشود. نخستین شبکیه دیجیتالی واقعی، به دهها هزار الکترود نیاز دارد که موجب میشوند این فرآیند، پیچیدهتر شود. بوریس مورمان، استاد مهندسی برق دانشگاه استنفورد گفت: ما روشی پیدا کردیم تا بتوانیم سطح درک تصویری را با استفاده از دادههای کمتری انجام دهیم. ما با درک بهتر توانستیم میزان دادههایی که باید پردازش شوند، کاهش دهیم. ما موفق شدیم با انتخاب دادهها، نمونههای اساسی و انتخاب دیجیتالی پالسهای منحصر به فرد، از میزان دادهها کم کنیم. وی افزود: پیش از این، مراحل دیجیتالسازی و فشردهسازی، به صورت جداگانه صورت میگرفتند و دادههای اضافی بسیاری را ذخیره و منتقل میکردند. Reference:https://engineering.stanford.edu/magazine/article/artificial-retina-could-help-restore-sight-blind
Reference:https://engineering.stanford.edu/magazine/article/artificial-retina-could-help-restore-sight-blind -
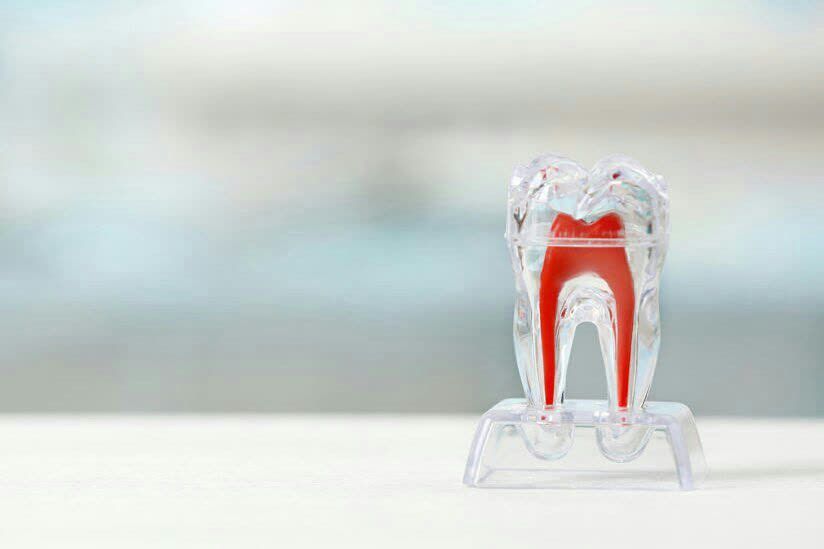
 استفاده از روشی موثر برای ترمیم طبیعی دندان
استفاده از روشی موثر برای ترمیم طبیعی دندان زمانی که دندان دچار تروما یا فساد می شود، سه لایه ممکن است تحت تاثیر قرار گیرند: لایه خارجی مینا، لایه میانی دنتین و لایه داخلی پالپ نرم دندان. پژوهش های گذشته نشان داده است که داروی Tideglusib می تواند با تحریک تولید لایه میانی(دنتین) به حفاظت از لایه داخلی کمک کند و اجازه ترمیم خودبخود دندان را بدهد. برای تست موثر بودن این روش در بیماران، محققین به بررسی این امر پرداختند که آیا حجم دنتیتن ترمیم کننده تولید شده برای ترمیم حفرات موجود در دندان انسان کافی است یا خیر. هم چنین آن ها به بررسی طیف دوز داروی مذکور پرداختند و میزان رسوب معدنی در دنتین ترمیم شده را نیز با دنتین طبیعی مقایسه کردند. آن ها کشف کردند که استفاده از این دارو موجب می شود که ناحیه ترمیم تنها به سلول های پالپ و درست در جایگاه آسیب محدود می شود و ریشه پالپ تحت تاثیر قرار نمی گیرد. هم چنین آن ها دریافتند که ناحیه رسوب معدنی ترمیم نیز به طور قابل توجهی با رسوب کلسیمی استخوان متفاوت بود و بیشتر شبیه دنتین طبیعی بود. علاوه براین مشخص شد که داروی Tideglusib می تواند ترمیم ناحیه آسیب دنتینی را فعال کرد و موجب ترمیم ناحیه ضایعه تا 10 برابر بیشتر شود. محققین بر این باورند که در آینده ای نزدیک ترمیم طبیعی دندان از طریق فعال کردن سلول های بنیادی موجود در دندان صورت می گیرد و می توان به دنبال تست داروها یا ترکیباتی بود که بتوانند این سلول ها را فعال کنند...
زمانی که دندان دچار تروما یا فساد می شود، سه لایه ممکن است تحت تاثیر قرار گیرند: لایه خارجی مینا، لایه میانی دنتین و لایه داخلی پالپ نرم دندان. پژوهش های گذشته نشان داده است که داروی Tideglusib می تواند با تحریک تولید لایه میانی(دنتین) به حفاظت از لایه داخلی کمک کند و اجازه ترمیم خودبخود دندان را بدهد. برای تست موثر بودن این روش در بیماران، محققین به بررسی این امر پرداختند که آیا حجم دنتیتن ترمیم کننده تولید شده برای ترمیم حفرات موجود در دندان انسان کافی است یا خیر. هم چنین آن ها به بررسی طیف دوز داروی مذکور پرداختند و میزان رسوب معدنی در دنتین ترمیم شده را نیز با دنتین طبیعی مقایسه کردند. آن ها کشف کردند که استفاده از این دارو موجب می شود که ناحیه ترمیم تنها به سلول های پالپ و درست در جایگاه آسیب محدود می شود و ریشه پالپ تحت تاثیر قرار نمی گیرد. هم چنین آن ها دریافتند که ناحیه رسوب معدنی ترمیم نیز به طور قابل توجهی با رسوب کلسیمی استخوان متفاوت بود و بیشتر شبیه دنتین طبیعی بود. علاوه براین مشخص شد که داروی Tideglusib می تواند ترمیم ناحیه آسیب دنتینی را فعال کرد و موجب ترمیم ناحیه ضایعه تا 10 برابر بیشتر شود. محققین بر این باورند که در آینده ای نزدیک ترمیم طبیعی دندان از طریق فعال کردن سلول های بنیادی موجود در دندان صورت می گیرد و می توان به دنبال تست داروها یا ترکیباتی بود که بتوانند این سلول ها را فعال کنند... Reference: https://medicalxpress.com/news/2020-03-evidence-clinical-viability-natural-tooth.html
Reference: https://medicalxpress.com/news/2020-03-evidence-clinical-viability-natural-tooth.html -

 تولید نوعی هیدروژل جدید قابل استفاده در مهندسی بافت استخوان
تولید نوعی هیدروژل جدید قابل استفاده در مهندسی بافت استخوان هیدروژل ها از شبکه های پلیمری ساخته شده اند و همان طور که گفته شد موثر بودن آن ها در انتقال داروها و سلول های بنیادی به بافت هدف ثابت شده است. اما در مورد جراحی دهان، استفاده از این هیدروژل ها کمتر موثر است زیرا خون و بزاق مانع از چسبندگی موثر آن به جایگاه جراحی شده می شوند و به همین دلیل کارایی آن به حداقل می رسد. به همین دلیل محققین به دنبال یافتن محصولی با چسبندگی بهینه در محیط دهان بوده اند. در این راستا محققان با الهام گرفتن از صدف های دریایی که توانایی چسبیدن به سطوح زیر آب را دارند، یک هیدروژل مبتنی بر آلژینات را تولید کردند. آلژینات ماده موجود در جلبک هاست و زمانی که هیدراته یا آب دار می شود به صورت چسبنده و آدامس مانند در می آید. آن ها این هیدروژل جدید بارگیری شده با سلول های بنیادی مشتق از بافت لثه را در یک مطالعه 18 هفته ای برای مدل های رتی پری ایمپلنتیت استفاده کردند. پری ایمپلنتیت یک بیماری عفونی است که منجر به التهاب لثه و ساختار پیرامون ایمپلنت دندانی می شود. ارزیابی ها نشان داد که در انتهای این 18 هفته استخوان پیرامون ایمپلنت ها در همه رت ها به طور کامل بازسازی شد. در این مطالعه محققین هیدروژل را به درون دهان رت و جایگاه هدف تزریق کردند و با یک تیمار نوری موجب جامد شدن این هیدروژل شدند. تیمار نوری موجب سفت شدن هیدروژل می شود تا یک ناقل با ثبات تر برای انتقال سلول های بنیادی به جایگاه آسیب باشند.
هیدروژل ها از شبکه های پلیمری ساخته شده اند و همان طور که گفته شد موثر بودن آن ها در انتقال داروها و سلول های بنیادی به بافت هدف ثابت شده است. اما در مورد جراحی دهان، استفاده از این هیدروژل ها کمتر موثر است زیرا خون و بزاق مانع از چسبندگی موثر آن به جایگاه جراحی شده می شوند و به همین دلیل کارایی آن به حداقل می رسد. به همین دلیل محققین به دنبال یافتن محصولی با چسبندگی بهینه در محیط دهان بوده اند. در این راستا محققان با الهام گرفتن از صدف های دریایی که توانایی چسبیدن به سطوح زیر آب را دارند، یک هیدروژل مبتنی بر آلژینات را تولید کردند. آلژینات ماده موجود در جلبک هاست و زمانی که هیدراته یا آب دار می شود به صورت چسبنده و آدامس مانند در می آید. آن ها این هیدروژل جدید بارگیری شده با سلول های بنیادی مشتق از بافت لثه را در یک مطالعه 18 هفته ای برای مدل های رتی پری ایمپلنتیت استفاده کردند. پری ایمپلنتیت یک بیماری عفونی است که منجر به التهاب لثه و ساختار پیرامون ایمپلنت دندانی می شود. ارزیابی ها نشان داد که در انتهای این 18 هفته استخوان پیرامون ایمپلنت ها در همه رت ها به طور کامل بازسازی شد. در این مطالعه محققین هیدروژل را به درون دهان رت و جایگاه هدف تزریق کردند و با یک تیمار نوری موجب جامد شدن این هیدروژل شدند. تیمار نوری موجب سفت شدن هیدروژل می شود تا یک ناقل با ثبات تر برای انتقال سلول های بنیادی به جایگاه آسیب باشند. Reference: https://stm.sciencemag.org/content/12/534/eaay6853
Reference: https://stm.sciencemag.org/content/12/534/eaay6853 -
 نوبل شیمی ۲۰۲۰ به دو محقق زن بهخاطر تحقیقات در زمینه مهندسی ژنوم رسید
نوبل شیمی ۲۰۲۰ به دو محقق زن بهخاطر تحقیقات در زمینه مهندسی ژنوم رسید مانوئل شارپنتیه، محقق فرانسوی و جنیفر دودنا، دانشمند آمریکایی به دلیل توسعه روش ویرایش ژنوم (مهندسی ژنوم) معروف به کریسپر یا «قیچی ژنتیکی»، برنده نوبل شیمی ۲۰۲۰ شدند. این تحقیقات نویدبخش بهبود بیماریهای ژنتیکی است.کمیته نوبل گفت که این روش به این معنی است که محققان میتوانند دیانای حیوانات، گیاهان و میکروارگانیسمها را «با دقت بسیار بالا» تغییر دهند.
مانوئل شارپنتیه، محقق فرانسوی و جنیفر دودنا، دانشمند آمریکایی به دلیل توسعه روش ویرایش ژنوم (مهندسی ژنوم) معروف به کریسپر یا «قیچی ژنتیکی»، برنده نوبل شیمی ۲۰۲۰ شدند. این تحقیقات نویدبخش بهبود بیماریهای ژنتیکی است.کمیته نوبل گفت که این روش به این معنی است که محققان میتوانند دیانای حیوانات، گیاهان و میکروارگانیسمها را «با دقت بسیار بالا» تغییر دهند.
 قیچی ژنتیکی روشی است که از آن برای بریدن و جدا کردن یک ژن معیوب استفاده میشود.
قیچی ژنتیکی روشی است که از آن برای بریدن و جدا کردن یک ژن معیوب استفاده میشود.
 کلیس گوستافسون، رئیس کمیته شیمی آکادمی نوبل گفت: «قدرت عظیمی در این ابزار ژنتیکی هست که همه ما را تحت تاثیر قرار میدهد. این نه تنها انقلابی در علوم پایه ایجاد کرده است بلکه منجر به تولید محصولات نوآورانه شده است که در درمانهای پیشگامانه پزشکی کاربرد خواهد داشت.»
کلیس گوستافسون، رئیس کمیته شیمی آکادمی نوبل گفت: «قدرت عظیمی در این ابزار ژنتیکی هست که همه ما را تحت تاثیر قرار میدهد. این نه تنها انقلابی در علوم پایه ایجاد کرده است بلکه منجر به تولید محصولات نوآورانه شده است که در درمانهای پیشگامانه پزشکی کاربرد خواهد داشت.» -
 شناسایی بیومارکری جدید برای غربالگری سلول های بنیادی مزانشیمی
شناسایی بیومارکری جدید برای غربالگری سلول های بنیادی مزانشیمی در حالی که صدها کارآزمایی بالینی که شامل هزاران بیماران هستند برای تست توانایی سلول های بنیادی مزانشیمی انسانی در درمان بیماری های مختلف از بیماری های قلبی تا آسیب های مغزی در دست انجام است اما هنوز راهی وجود ندارد که کیفیت سلول های بنیادی قبل از این که اهدا کننده متحمل رویکرد دردناک جمع آوری سلول از مغز استخوان و ... شود تعیین شود.
در حالی که صدها کارآزمایی بالینی که شامل هزاران بیماران هستند برای تست توانایی سلول های بنیادی مزانشیمی انسانی در درمان بیماری های مختلف از بیماری های قلبی تا آسیب های مغزی در دست انجام است اما هنوز راهی وجود ندارد که کیفیت سلول های بنیادی قبل از این که اهدا کننده متحمل رویکرد دردناک جمع آوری سلول از مغز استخوان و ... شود تعیین شود.
 اما مطالعه ای جدید بوسیله پژوهشگران A*STAR بیومارکری بالقوه را برای پیش غربالگری ظرفیت و پتانسیل رشد سلول های بنیادی مزانشیمی پیشنهاد کرده است. در مطالعات گذشته این تیم تحقیقاتی سلول های بنیادی مزانشیمی انسانی را از نظر سن و تطبیق جنسیتی اهدا کننده به گروه های با ظرفیت رشد کم و زیاد دسته بندی کردند و معیارهایی را برای شناسایی سلول های بنیادی با پتانسیل تقویت شده ارائه کردند.
اما مطالعه ای جدید بوسیله پژوهشگران A*STAR بیومارکری بالقوه را برای پیش غربالگری ظرفیت و پتانسیل رشد سلول های بنیادی مزانشیمی پیشنهاد کرده است. در مطالعات گذشته این تیم تحقیقاتی سلول های بنیادی مزانشیمی انسانی را از نظر سن و تطبیق جنسیتی اهدا کننده به گروه های با ظرفیت رشد کم و زیاد دسته بندی کردند و معیارهایی را برای شناسایی سلول های بنیادی با پتانسیل تقویت شده ارائه کردند. این سلول های بنیادی مزانشیمی انسانی پتانسیل تکثیری افزایش یافته ای را نشان دادند که با کلونی زایی تقویت شده آن ها، بیان مارکرهای خاص سطح سلولی و به طور مهم تر توانایی بهبود یافته آن ها برای وساطت کردن تشکیل استخوان نابجا مرتبط بودند. اما در این پژوهش جدید آن ها به آنالیز مولکولی این سلول ها نیز پرداختند تا بتوانند توانایی سلول ها را بهبود ببخشند. آنالیز میکرواری نشان داد که سلول های بنیادی مزانشیمی با حذف ژنومی گلوتاتیون S-ترانسفراز تتا(GSTT1)، ظرفیت رشد زیادی دارند. سلول های بنیادی مزانشیمی انسانی فاقد GSTT1 توانایی کلونی زایی بالایی را نیز نشان می دهند و تلومرازهای طویل تری دارند. هر دو این معیارها برای تعیین پتانسیل سلول های بنیادی مزانشیمی مهم هستند. این مطالعه GSTT1 را یک بیومارکر بالقوه برای تولید مقادیر انبوه سلول های بنیادی مزانشیمی معرفی کرده است و ممکن است در انتخاب اهدا کننده های بالقوه برای ایجاد ذخیره های با کیفیت سلول های بنیادی مزانشیمی و بهبود سلول درمانی موثر باشد.
این سلول های بنیادی مزانشیمی انسانی پتانسیل تکثیری افزایش یافته ای را نشان دادند که با کلونی زایی تقویت شده آن ها، بیان مارکرهای خاص سطح سلولی و به طور مهم تر توانایی بهبود یافته آن ها برای وساطت کردن تشکیل استخوان نابجا مرتبط بودند. اما در این پژوهش جدید آن ها به آنالیز مولکولی این سلول ها نیز پرداختند تا بتوانند توانایی سلول ها را بهبود ببخشند. آنالیز میکرواری نشان داد که سلول های بنیادی مزانشیمی با حذف ژنومی گلوتاتیون S-ترانسفراز تتا(GSTT1)، ظرفیت رشد زیادی دارند. سلول های بنیادی مزانشیمی انسانی فاقد GSTT1 توانایی کلونی زایی بالایی را نیز نشان می دهند و تلومرازهای طویل تری دارند. هر دو این معیارها برای تعیین پتانسیل سلول های بنیادی مزانشیمی مهم هستند. این مطالعه GSTT1 را یک بیومارکر بالقوه برای تولید مقادیر انبوه سلول های بنیادی مزانشیمی معرفی کرده است و ممکن است در انتخاب اهدا کننده های بالقوه برای ایجاد ذخیره های با کیفیت سلول های بنیادی مزانشیمی و بهبود سلول درمانی موثر باشد.
 Reference: https://stemcellsjournals.onlinelibrary.wiley.com/doi/full/10.1002/stem.3203
Reference: https://stemcellsjournals.onlinelibrary.wiley.com/doi/full/10.1002/stem.3203
@دانش-آموزان-آلاء -
 استفاده از پروتئین های انسانی برای تولید مواد اولیه در مهندسی بافت عروق
استفاده از پروتئین های انسانی برای تولید مواد اولیه در مهندسی بافت عروق نخ های مورد استفاده برای تولید بافت ها یا نسوج جدید از زیست ماده ای موسوم به ماتریکس سازماندهی شده که بوسیله سلول(CAM) تولید شده اند است. بخش اعظم CAM را کلاژن تشکیل می دهد که فراوان ترین پروتئین بدن است و موجب استحکام مکانیکی بافت ها و اندام های بدن می شود. CAM به خوبی بوسیله بدن پذیرفته می شود زیرا به طور کامل از بدن انسان مشتق شده است و هیچ ماده افزودنی شیمیایی را دارا نیست. در مطالعه ای جدید، محققین صفحات CAM را برش داده و به صورت نوارها یا ریبون هایی در آورند که می تواند به صورت مستقیم یا به صورت پیچ و تاب دار به عنوان نخ استفاده شوند. این نخ ها برای بافته شدن و تولید عروق خونی استفاده شدند و بدون این که ماده شیمیایی به آن ها افزوده شود، ویژگی های مکانیکی عالی را از خود نشان دادند. در حال حاضر پروتوتایپ های مختلفی از عروق خونی بوسیله این الیاف CAM تولید شده است و محققین بدنبال بهینه سازی روش های مدیریت کردن ساخت نخ ها و نوارهای CAM هستند.
نخ های مورد استفاده برای تولید بافت ها یا نسوج جدید از زیست ماده ای موسوم به ماتریکس سازماندهی شده که بوسیله سلول(CAM) تولید شده اند است. بخش اعظم CAM را کلاژن تشکیل می دهد که فراوان ترین پروتئین بدن است و موجب استحکام مکانیکی بافت ها و اندام های بدن می شود. CAM به خوبی بوسیله بدن پذیرفته می شود زیرا به طور کامل از بدن انسان مشتق شده است و هیچ ماده افزودنی شیمیایی را دارا نیست. در مطالعه ای جدید، محققین صفحات CAM را برش داده و به صورت نوارها یا ریبون هایی در آورند که می تواند به صورت مستقیم یا به صورت پیچ و تاب دار به عنوان نخ استفاده شوند. این نخ ها برای بافته شدن و تولید عروق خونی استفاده شدند و بدون این که ماده شیمیایی به آن ها افزوده شود، ویژگی های مکانیکی عالی را از خود نشان دادند. در حال حاضر پروتوتایپ های مختلفی از عروق خونی بوسیله این الیاف CAM تولید شده است و محققین بدنبال بهینه سازی روش های مدیریت کردن ساخت نخ ها و نوارهای CAM هستند. Reference: https://medicalxpress.com/news/2020-04-human-tissue-blood-vessels.html
Reference: https://medicalxpress.com/news/2020-04-human-tissue-blood-vessels.html -
 تلاش محققان برای بازسازی آسیب های نخاعی در مدل های جانوری
تلاش محققان برای بازسازی آسیب های نخاعی در مدل های جانوری پژوهشی جدید نشان می دهد که برخلاف تصور موجود، بدست آوردن عملکرد مجدد آکسون ها که بدلیل آسیب های رخ داده از بین می رود امکان پذیر است و این امر به وجود مولکولی موسوم به Lin28 مربوط است که رشد سلولی را تنظیم می کند. در این مطالعه جدید محققین نشان داده اند که افزایش بیان Lin28 در مدل موشی آسیب نخاعی و هم آسیب عصب بینایی موجب افزایش رشد مجدد آکسون ها می شود و این جانور مجددا قادر به برقراری ارتباط با بخش های مختلف بدنش است. یافته ها حاکی از این است که Lin28 یک تنظیم کننده اصلی بازسازی آکسونی و یک هدف درمانی امیدوار کننده برای آسیب های سیستم عصبی مرکزی است. این اولین بار است که توانایی قابل توجه تنظیم افزایشی Lin28 در بازسازی آسیب های نخاعی در مدل های جانوری نشان داده شده است.
پژوهشی جدید نشان می دهد که برخلاف تصور موجود، بدست آوردن عملکرد مجدد آکسون ها که بدلیل آسیب های رخ داده از بین می رود امکان پذیر است و این امر به وجود مولکولی موسوم به Lin28 مربوط است که رشد سلولی را تنظیم می کند. در این مطالعه جدید محققین نشان داده اند که افزایش بیان Lin28 در مدل موشی آسیب نخاعی و هم آسیب عصب بینایی موجب افزایش رشد مجدد آکسون ها می شود و این جانور مجددا قادر به برقراری ارتباط با بخش های مختلف بدنش است. یافته ها حاکی از این است که Lin28 یک تنظیم کننده اصلی بازسازی آکسونی و یک هدف درمانی امیدوار کننده برای آسیب های سیستم عصبی مرکزی است. این اولین بار است که توانایی قابل توجه تنظیم افزایشی Lin28 در بازسازی آسیب های نخاعی در مدل های جانوری نشان داده شده است.
@دانش-آموزان-آلاء -
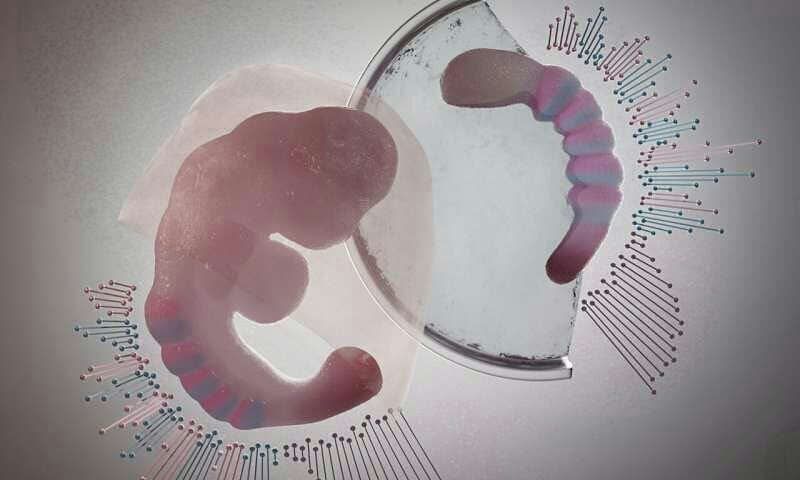
 ساخت مدل جدیدی از جنین برای مطالعه فرایند تکوین
ساخت مدل جدیدی از جنین برای مطالعه فرایند تکوین محققین مدل جدیدی را برای مطالعه مراحل اولیه تکوین انسان با استفاده از سلول های بنیادی جنینی ارائه کرده اند. این مدل جدید برخی از عناصر کلیدی یک جنین تقریبا 18 تا 21 روزه را شبیه سازی می کند و به محققین اجازه می دهد که فرایندهای دخیل در تشکیل بدن انسان را به طور مستقیم مشاهده کنند، فرایندی که پیش از این امکان پذیر نبود. درک این فرایندها می تواند دلیل بسیاری از نواقصی که در زمان تولد به همراه نوزاد هستند و هم چنین بسیاری از بیماری های تکوینی که در زمان حضور جنین در رحم مادر بروز می کنند را نشان دهد. طرح یا نقش بدن یک موجود(از جمله انسان) طی فرایند گاسترولاسیون شکل می گیرد و حاصل آن تولید لایه های سلولی است که بدن جنین را شکل می دهند(اکتودرم، مزودرم و اندودرم) و در نهایت به اندام ها و بافت های مختلف بدن تمایز می یابند. فرایند گاسترولاسیون را معمولا جعبه سیاه تکوین انسانی می دانند و بسیاری از اتفاقاتی که در بدن در سال های بعد مشاهده می شود را به اتفاقات این فرایند و این دوره زمانی نسبت می دهند. به همین دلیل درک بهتر فرایند گاسترولاسیون می تواند به درک بهتر تکوین فیزیولوژیک و پاتولوژیک انسان کمک کند.
محققین مدل جدیدی را برای مطالعه مراحل اولیه تکوین انسان با استفاده از سلول های بنیادی جنینی ارائه کرده اند. این مدل جدید برخی از عناصر کلیدی یک جنین تقریبا 18 تا 21 روزه را شبیه سازی می کند و به محققین اجازه می دهد که فرایندهای دخیل در تشکیل بدن انسان را به طور مستقیم مشاهده کنند، فرایندی که پیش از این امکان پذیر نبود. درک این فرایندها می تواند دلیل بسیاری از نواقصی که در زمان تولد به همراه نوزاد هستند و هم چنین بسیاری از بیماری های تکوینی که در زمان حضور جنین در رحم مادر بروز می کنند را نشان دهد. طرح یا نقش بدن یک موجود(از جمله انسان) طی فرایند گاسترولاسیون شکل می گیرد و حاصل آن تولید لایه های سلولی است که بدن جنین را شکل می دهند(اکتودرم، مزودرم و اندودرم) و در نهایت به اندام ها و بافت های مختلف بدن تمایز می یابند. فرایند گاسترولاسیون را معمولا جعبه سیاه تکوین انسانی می دانند و بسیاری از اتفاقاتی که در بدن در سال های بعد مشاهده می شود را به اتفاقات این فرایند و این دوره زمانی نسبت می دهند. به همین دلیل درک بهتر فرایند گاسترولاسیون می تواند به درک بهتر تکوین فیزیولوژیک و پاتولوژیک انسان کمک کند.
 در مطالعه جدید صورت گرفته در دانشگاه کمبریج، محققین از سلول های بنیادی جنینی برای تولید تجمعات سه بعدی سلولی موسوم به "گاسترولوئید(gastruloid)" استفاده کرده اند که در رویکردی بسیار شبیه تکوین طبیعی انسان به سه لایه سازمان یافته بدن انسان تمایز می یابد. برای تولید گاسترولوئیدها در آزمایشگاه، تعداد مشخصی از سلول های بنیادی جنینی انسانی در فضای کوچکی رشد یافتند تا تجمعات متراکمی را شکل دهند. بعد از تیمار با سیگنال های شیمیایی، گاسترولوئیدها در امتداد یک محور سر به دم موسوم به محور قدامی -خلفی کشیده شدند و در یک الگوی خاص، ژن هایی روشن شدند که منعکس کننده عناصری از طرح بدنی پستانداران بودند. گاسترولوئیدها پتانسیل تبدیل شدن به جنین کاملا دارای عملکرد را ندارند و بافت های مورد نیاز برای لانه گزینی درون رحم را نیز دارا نیستند اما می توانند در مقایسه با مدل های جانوری مانند موش یا گورخرماهی اطلاعات درست تری از روند تکوینی بدن انسان ارائه دهند و مدل های مناسب تری برای درک اطلاعات پایه و برای غربالگری های دارویی نیز ارائه می دهند.
در مطالعه جدید صورت گرفته در دانشگاه کمبریج، محققین از سلول های بنیادی جنینی برای تولید تجمعات سه بعدی سلولی موسوم به "گاسترولوئید(gastruloid)" استفاده کرده اند که در رویکردی بسیار شبیه تکوین طبیعی انسان به سه لایه سازمان یافته بدن انسان تمایز می یابد. برای تولید گاسترولوئیدها در آزمایشگاه، تعداد مشخصی از سلول های بنیادی جنینی انسانی در فضای کوچکی رشد یافتند تا تجمعات متراکمی را شکل دهند. بعد از تیمار با سیگنال های شیمیایی، گاسترولوئیدها در امتداد یک محور سر به دم موسوم به محور قدامی -خلفی کشیده شدند و در یک الگوی خاص، ژن هایی روشن شدند که منعکس کننده عناصری از طرح بدنی پستانداران بودند. گاسترولوئیدها پتانسیل تبدیل شدن به جنین کاملا دارای عملکرد را ندارند و بافت های مورد نیاز برای لانه گزینی درون رحم را نیز دارا نیستند اما می توانند در مقایسه با مدل های جانوری مانند موش یا گورخرماهی اطلاعات درست تری از روند تکوینی بدن انسان ارائه دهند و مدل های مناسب تری برای درک اطلاعات پایه و برای غربالگری های دارویی نیز ارائه می دهند. Reference: https://www.nature.com/articles/s41586-020-2024-3
Reference: https://www.nature.com/articles/s41586-020-2024-3
@دانش-آموزان-آلاء -
 نوعی هیدروژل جدید برای استفاده در مهندسی بافت
نوعی هیدروژل جدید برای استفاده در مهندسی بافت این هیدروژل مبتنی بر کربوهیدرات گیاهی یا همان پکتین است که با استفاده از روش های مهندسی زیستی طراحی شده است. هدف اصلی طراحی این هیدروژل، استفاده برای احیای بافت عصبی بعد از برداشتن تومورهای مغزی و یا سایر آسیب های ناشی از تروما و بیماری های مخرب عصبی است که منجر به از دست رفتن فعالیت سلولی می شود. هم چنین به عقیده محققین، این هیدروژل مبتنی بر پکتین با ساختار شیمیایی که دارد می تواند پتانسیل سلول های بنیادی عصبی را حفظ کرده و موجب حفظ بنیادینگی آن ها شده و زنده مانی آن ها را نیز تضمین کند. به عقیده محققین این هیدروژل می تواند برای بارگیری و انتقال داروهای ضد سرطانی استفاده شود به نحوی که با استفاده از این هیدروژل ناحیه ای که تومور از آن قسمت برداشته شده است را پر کرده و داروهای موجود در آن مانع از رشد مجدد سلول های باقی مانده می شوند. هم چنین این هیدروژل می تواند با پروتئین ها یا ترکیباتی که رشد سلول های بنیادی و یا سلول های موجود در بافت را تحریک می کنند بارگیری شود و موجب ترمیم ناحیه آسیب دیده گردد.
این هیدروژل مبتنی بر کربوهیدرات گیاهی یا همان پکتین است که با استفاده از روش های مهندسی زیستی طراحی شده است. هدف اصلی طراحی این هیدروژل، استفاده برای احیای بافت عصبی بعد از برداشتن تومورهای مغزی و یا سایر آسیب های ناشی از تروما و بیماری های مخرب عصبی است که منجر به از دست رفتن فعالیت سلولی می شود. هم چنین به عقیده محققین، این هیدروژل مبتنی بر پکتین با ساختار شیمیایی که دارد می تواند پتانسیل سلول های بنیادی عصبی را حفظ کرده و موجب حفظ بنیادینگی آن ها شده و زنده مانی آن ها را نیز تضمین کند. به عقیده محققین این هیدروژل می تواند برای بارگیری و انتقال داروهای ضد سرطانی استفاده شود به نحوی که با استفاده از این هیدروژل ناحیه ای که تومور از آن قسمت برداشته شده است را پر کرده و داروهای موجود در آن مانع از رشد مجدد سلول های باقی مانده می شوند. هم چنین این هیدروژل می تواند با پروتئین ها یا ترکیباتی که رشد سلول های بنیادی و یا سلول های موجود در بافت را تحریک می کنند بارگیری شود و موجب ترمیم ناحیه آسیب دیده گردد.
 Reference: https://www.eurekalert.org/pub_releases/2020-08/fefu-fsp081320.php
Reference: https://www.eurekalert.org/pub_releases/2020-08/fefu-fsp081320.php -

#معرفی
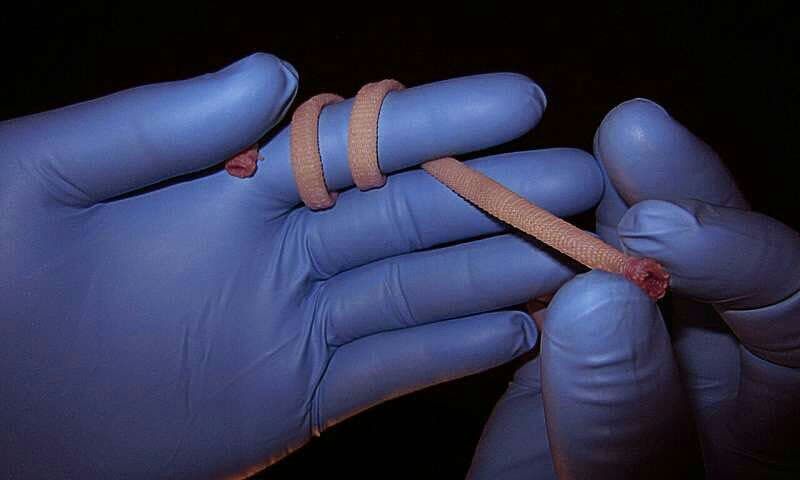
 دکتر محسن اکبری، محقق و دانشیار ایرانی دانشگاه ویکتوریا و حاصل تحقیقاتش در زمینه زخم پوش هاي نوين و هوشمند
دکتر محسن اکبری، محقق و دانشیار ایرانی دانشگاه ویکتوریا و حاصل تحقیقاتش در زمینه زخم پوش هاي نوين و هوشمند



 29 سپتامبر 2017 ، دکتر محسن اکبری، محقق و دانشیار ایرانی دانشگاه ویکتوریا، از حاصل تحقیقاتش در زمینه زخم پوش هاي نوين و هوشمند رونمايي كرد.
29 سپتامبر 2017 ، دکتر محسن اکبری، محقق و دانشیار ایرانی دانشگاه ویکتوریا، از حاصل تحقیقاتش در زمینه زخم پوش هاي نوين و هوشمند رونمايي كرد.
 ️این محقق ایرانی که از جمله افراد فعال در حوزه بیومواد است موفق به تولید یک بانداژ هوشمند از جنس ژل شد که با داشتن سنسورهای متعدد در درونش می تواند با اپلیکیشن نصب شده بر روی موبایل ارتباط برقرار کرده و گزارش کاملی از وضعیت زخم و عفونت های موجود در زخم را به پزشک معالج بدهد.
️این محقق ایرانی که از جمله افراد فعال در حوزه بیومواد است موفق به تولید یک بانداژ هوشمند از جنس ژل شد که با داشتن سنسورهای متعدد در درونش می تواند با اپلیکیشن نصب شده بر روی موبایل ارتباط برقرار کرده و گزارش کاملی از وضعیت زخم و عفونت های موجود در زخم را به پزشک معالج بدهد.
 ️ اکبری و همکارانش که این پروژه را بصورت مشترک با دانشگاه هاروراد و بخش ارتباط با صنعت دانشگاه ویکتوریا انجام دادند، نام محصول نهائی را ژل درم نامیدند و پس از ثبت پتنت آن، از ورود آن به بازار جهانی خبر دادند.
️ اکبری و همکارانش که این پروژه را بصورت مشترک با دانشگاه هاروراد و بخش ارتباط با صنعت دانشگاه ویکتوریا انجام دادند، نام محصول نهائی را ژل درم نامیدند و پس از ثبت پتنت آن، از ورود آن به بازار جهانی خبر دادند.
 ️ این محصول توانائی تشخیص تغییر در اسیدیته زخم را نیز دارد و در صورت بررسی نمودارهای پیگیری درمان زخم در اپلیکیشن و نیاز به تجویز آنتی بیوتیک ها بدون برداشت بانداژ هوشمند امکان اضافه کردن انواع داروها به بانداژ جهت رهایش آهسته آنها وجود دارد.
️ این محصول توانائی تشخیص تغییر در اسیدیته زخم را نیز دارد و در صورت بررسی نمودارهای پیگیری درمان زخم در اپلیکیشن و نیاز به تجویز آنتی بیوتیک ها بدون برداشت بانداژ هوشمند امکان اضافه کردن انواع داروها به بانداژ جهت رهایش آهسته آنها وجود دارد.
 ️ اکبری و سایر محققان تیمش معتقدند که با توجه به وجود درصد بالای انواع زخم در جهان و خطر احتمال عفونت در زخم ها بویژه زخم های گسترده و مانیتورینگ سخت زخم ها این بانداژ در طول پنج سال آینده رقیب سرسختی برای محصولات نوین زخم موجود در بازار خواهد شد.
️ اکبری و سایر محققان تیمش معتقدند که با توجه به وجود درصد بالای انواع زخم در جهان و خطر احتمال عفونت در زخم ها بویژه زخم های گسترده و مانیتورینگ سخت زخم ها این بانداژ در طول پنج سال آینده رقیب سرسختی برای محصولات نوین زخم موجود در بازار خواهد شد.
 ️ علاوه بر آنچه ذکر شد، بزرگترین مزیت های رقابتی بانداژ ژل درم که آن را از سایر محصولات حوزه زخم پوش نوین متفاوت میکند، عدم نیاز به منبع الکتریکی برای فعالیت سنسورها است که طبق اظهارات اکبری نخستین بانداژ هوشمند جهان بدون نیاز به پاور است.
️ علاوه بر آنچه ذکر شد، بزرگترین مزیت های رقابتی بانداژ ژل درم که آن را از سایر محصولات حوزه زخم پوش نوین متفاوت میکند، عدم نیاز به منبع الکتریکی برای فعالیت سنسورها است که طبق اظهارات اکبری نخستین بانداژ هوشمند جهان بدون نیاز به پاور است. -
 کامپوزیتی جدید برای مهندسی بافت استخوان
کامپوزیتی جدید برای مهندسی بافت استخوان گروهی از پژوهشگران ، طی پروژهای موفق شدهاند ماده کامپوزیتی جدیدی را برای مهندسی بافت به خصوص بازسازی بافت استخوان ابداع کنند. "ژوزه لوئیس ویلاس ویللا"(José Luis Vilas-Vilela)، از نویسندگان این پژوهش گفت: هدف نهایی پژوهش این است که بافتی برای درمان بیماریهای مربوط به استخوان تولید کنیم. این ماده جدید، چارچوبی را شامل میشود که یکی از ترکیبات اصلی ابریشم یعنی فیبروئین را در بر دارد که طبیعی و قابل تجزیه زیستی است.
گروهی از پژوهشگران ، طی پروژهای موفق شدهاند ماده کامپوزیتی جدیدی را برای مهندسی بافت به خصوص بازسازی بافت استخوان ابداع کنند. "ژوزه لوئیس ویلاس ویللا"(José Luis Vilas-Vilela)، از نویسندگان این پژوهش گفت: هدف نهایی پژوهش این است که بافتی برای درمان بیماریهای مربوط به استخوان تولید کنیم. این ماده جدید، چارچوبی را شامل میشود که یکی از ترکیبات اصلی ابریشم یعنی فیبروئین را در بر دارد که طبیعی و قابل تجزیه زیستی است. پژوهشگران این ماده را با نانوذرات مغناطیسی بارگیری کردند تا مادهای که ارائه میدهند، فعال مغناطیسی باشد و هنگامی که یک دامنه مغناطیسی به آن اعمال میشود، واکنش نشان دهد. بدینترتیب، این ماده میتواند محرکهای مکانیکی و الکتریکی را به سلولها منتقل کند. نکته جالب در مورد محرکها این است که میتوانند الکتریکی، مغناطیسی، مکانیکی و یا از نوع دیگری باشند و به رشد سلول کمک کنند زیرا این فرآیند، به تقلید از ریزمحیط سلول میپردازد که عملکرد سلولها معمولا در آنجا صورت میگیرد.
پژوهشگران این ماده را با نانوذرات مغناطیسی بارگیری کردند تا مادهای که ارائه میدهند، فعال مغناطیسی باشد و هنگامی که یک دامنه مغناطیسی به آن اعمال میشود، واکنش نشان دهد. بدینترتیب، این ماده میتواند محرکهای مکانیکی و الکتریکی را به سلولها منتقل کند. نکته جالب در مورد محرکها این است که میتوانند الکتریکی، مغناطیسی، مکانیکی و یا از نوع دیگری باشند و به رشد سلول کمک کنند زیرا این فرآیند، به تقلید از ریزمحیط سلول میپردازد که عملکرد سلولها معمولا در آنجا صورت میگیرد. ویللا ادامه داد: نتایج پژوهش نشان میدهند که این چارچوب میتواند به ترغیب رشد سلول کمک کند. سلول با کمک این روش میتواند رشد بهتری داشته باشد. ما در پژوهش خود برای نخستین بار، تاثیر مثبت محرک مغناطیسی را بر رشد سلول نشان دادهایم. این پژوهش، گامی به سوی بررسی مواد و روشهای مناسب برای ساخت بافت است. ویللا افزود: ما میدانیم که هدف ما یک هدف بلندمدت است و ما هنوز در حال برداشتن گامهای نخست هستیم.
ویللا ادامه داد: نتایج پژوهش نشان میدهند که این چارچوب میتواند به ترغیب رشد سلول کمک کند. سلول با کمک این روش میتواند رشد بهتری داشته باشد. ما در پژوهش خود برای نخستین بار، تاثیر مثبت محرک مغناطیسی را بر رشد سلول نشان دادهایم. این پژوهش، گامی به سوی بررسی مواد و روشهای مناسب برای ساخت بافت است. ویللا افزود: ما میدانیم که هدف ما یک هدف بلندمدت است و ما هنوز در حال برداشتن گامهای نخست هستیم. -
#اخبار_جدید_سلولهای_بنیادی
 استرس منجر به مرگ سلول های بنیادی عصبی هیپوکامپ می شود.
استرس منجر به مرگ سلول های بنیادی عصبی هیپوکامپ می شود. در مطالعه ای جدید، محققین برای اولین بار نشان داده اند که استرس مزمن منجر به مرگ اتوفاژی سلول های بنیادی عصبی در هیپوکامپ بالغ می شود. اتوفاژی که به یونانی به معنایی خودخواری است، فرایندی سلولی برای محافظت از سلول ها در برابر شرایط ناخواسته از طریق هضم و بازیافت مواد داخل سلولی است و بدین ترتیب سلول های می توانند ترکیبات سمی و پیر موجود در درون سلول را حذف کنند و مواد غذایی و متابولیت ها را بدست آورند. این فرایند مفید، در شرایط خاص می تواند به فرایند خود تخریب کننده تبدیل شود و منجر به مرگ سلولی اتوفاژی شود. در این مطالعه محققین با استفاده از سلول های بنیادی عصبی مشتق از جوندگان و موش های اصلاح ژنتیک شده کشف کردند که مرگ سلول های بنیادی عصبی هیپوکامپی زمانی که Atg7 (یکی از ژن های اتوفاژی اصلی) حذف شد، بدون ایجاد علایم استرس، مانع از مرگ سلول های بنیادی عصبی شد و عملکردهای مغزی طبیعی را حفظ کرد. این مطالعه برای اولین بار نشان می دهد که نواقص شناختی و اختلالات روانی ناشی از استرس از طریق مرگ اتوفاژی سلول های بنیادی عصبی هیپوکامپی ایجاد می شود.
در مطالعه ای جدید، محققین برای اولین بار نشان داده اند که استرس مزمن منجر به مرگ اتوفاژی سلول های بنیادی عصبی در هیپوکامپ بالغ می شود. اتوفاژی که به یونانی به معنایی خودخواری است، فرایندی سلولی برای محافظت از سلول ها در برابر شرایط ناخواسته از طریق هضم و بازیافت مواد داخل سلولی است و بدین ترتیب سلول های می توانند ترکیبات سمی و پیر موجود در درون سلول را حذف کنند و مواد غذایی و متابولیت ها را بدست آورند. این فرایند مفید، در شرایط خاص می تواند به فرایند خود تخریب کننده تبدیل شود و منجر به مرگ سلولی اتوفاژی شود. در این مطالعه محققین با استفاده از سلول های بنیادی عصبی مشتق از جوندگان و موش های اصلاح ژنتیک شده کشف کردند که مرگ سلول های بنیادی عصبی هیپوکامپی زمانی که Atg7 (یکی از ژن های اتوفاژی اصلی) حذف شد، بدون ایجاد علایم استرس، مانع از مرگ سلول های بنیادی عصبی شد و عملکردهای مغزی طبیعی را حفظ کرد. این مطالعه برای اولین بار نشان می دهد که نواقص شناختی و اختلالات روانی ناشی از استرس از طریق مرگ اتوفاژی سلول های بنیادی عصبی هیپوکامپی ایجاد می شود. Reference: https://medicalxpress.com/pdf484566089.pdf
Reference: https://medicalxpress.com/pdf484566089.pdf -
 تلاش محققان برای مقابله با پارکینسون به کمک سلول های بنیادی
تلاش محققان برای مقابله با پارکینسون به کمک سلول های بنیادی بیماری پارکینسون را با از دست رفتن نوعی خاص از نورون ها موسوم به نورون های دوپامینرژیک می شناسند. این امر اثر منفی روی ارتباطات عصبی دارد و موجب می شود که قدرت کنترل حرکاتش را نداشته باشد. در حال حاضر درمان موثری برای این بیماری وجود ندارد و بیشتر درمان ها هم تنها علایم بیماری را کنترل می کنند و به همین دلیل محققین بسیاری در استفاده از پتانسیل سلول های بنیادی برای درمان این بیماری داشته اند.سلول های بنیادی می توانند تحریک شده و نورون های دوپامینرژیکی تمایز یابند که تحت تاثیر پارکینسون قرار گرفته اند. پیوند این نورون های مشتق از سلول های بنیادی به مغز بیماران می تواند یک درمان موثر برای پارکینسون باشد.
بیماری پارکینسون را با از دست رفتن نوعی خاص از نورون ها موسوم به نورون های دوپامینرژیک می شناسند. این امر اثر منفی روی ارتباطات عصبی دارد و موجب می شود که قدرت کنترل حرکاتش را نداشته باشد. در حال حاضر درمان موثری برای این بیماری وجود ندارد و بیشتر درمان ها هم تنها علایم بیماری را کنترل می کنند و به همین دلیل محققین بسیاری در استفاده از پتانسیل سلول های بنیادی برای درمان این بیماری داشته اند.سلول های بنیادی می توانند تحریک شده و نورون های دوپامینرژیکی تمایز یابند که تحت تاثیر پارکینسون قرار گرفته اند. پیوند این نورون های مشتق از سلول های بنیادی به مغز بیماران می تواند یک درمان موثر برای پارکینسون باشد. در مطالعه ای جدید محققین از بیورآکتورهای کنترل شونده بوسیله کامپیوتر برای تکثیر سلول های بنیادی مزانشیمی مشتق از مغز استخوان و بند ناف استفاده کردند. تزریق این سلول ها به مدل جانوری پارکینسون موجب تولید نورون های بالغ در مغز جانور شد که خود منجر به ریکاوری فیزیکی هر چه بیشتر جانور گردید. نتایج بدست آمده از تست های حرکتی حاکی از موثرتر بودن سلول های بنیادی مزانشیمی مشتق از بند ناف در تسکین و تلطیف علایم پارکینسون و بهبود قابلیت های حرکتی جانور در مقایسه با سلول های بنیادی مزانشیمی مشتق از مغز استخوان بود.
در مطالعه ای جدید محققین از بیورآکتورهای کنترل شونده بوسیله کامپیوتر برای تکثیر سلول های بنیادی مزانشیمی مشتق از مغز استخوان و بند ناف استفاده کردند. تزریق این سلول ها به مدل جانوری پارکینسون موجب تولید نورون های بالغ در مغز جانور شد که خود منجر به ریکاوری فیزیکی هر چه بیشتر جانور گردید. نتایج بدست آمده از تست های حرکتی حاکی از موثرتر بودن سلول های بنیادی مزانشیمی مشتق از بند ناف در تسکین و تلطیف علایم پارکینسون و بهبود قابلیت های حرکتی جانور در مقایسه با سلول های بنیادی مزانشیمی مشتق از مغز استخوان بود.
 Reference: https://www.dovepress.com/transplantation-of-human-umbilical-cord-blood-derived-mononuclear-cell-peer-reviewed-article-JN
Reference: https://www.dovepress.com/transplantation-of-human-umbilical-cord-blood-derived-mononuclear-cell-peer-reviewed-article-JN
@دانش-آموزان-آلاء -


 #معرفی افراد برجسته حوزه پزشکی بازساختی
#معرفی افراد برجسته حوزه پزشکی بازساختی رابرت لانزا
رابرت لانزا پزشک و دانشمند آمریکائی که هم اکنون ریاست موسسه پزشکی بازساختی Astellas را برعهده دارد.
پزشک و دانشمند آمریکائی که هم اکنون ریاست موسسه پزشکی بازساختی Astellas را برعهده دارد. در اکتبر 2014 لانزا و همکارانش مقاله ای را در مجله لانست چاپ کردند که برای نخستین بار شواهدی از استفاده سلول های بنیادی پرتوان القائی در بیماران مبتلا Stargardt یا dry-AMD با پیگیری طولانی مدت سه ساله و تائید سلامت و کارائی این سلول ها را نشان می داد.
در اکتبر 2014 لانزا و همکارانش مقاله ای را در مجله لانست چاپ کردند که برای نخستین بار شواهدی از استفاده سلول های بنیادی پرتوان القائی در بیماران مبتلا Stargardt یا dry-AMD با پیگیری طولانی مدت سه ساله و تائید سلامت و کارائی این سلول ها را نشان می داد. لانزا در همین سال بعنوان یکی از 100 چهره موثر در جهان از سوی مجله تایم انتخاب شد. عمده تحقیقات وی در زمینه چشم و سلول های بنیادی بوده است.
لانزا در همین سال بعنوان یکی از 100 چهره موثر در جهان از سوی مجله تایم انتخاب شد. عمده تحقیقات وی در زمینه چشم و سلول های بنیادی بوده است. پیش از سال 2014، یکی از دلایل شهرت لانزا چاپ مقاله و مطرح کردن ایده ای تحت عنوان جهان بیوسنتریک بود که در آن لانزا سعی کرده بود به تشریح اهمیت علم زیست شناسی بپردازد و جایگاه این علم را بالاتر از تمام علوم دیگر تشریح کند.
پیش از سال 2014، یکی از دلایل شهرت لانزا چاپ مقاله و مطرح کردن ایده ای تحت عنوان جهان بیوسنتریک بود که در آن لانزا سعی کرده بود به تشریح اهمیت علم زیست شناسی بپردازد و جایگاه این علم را بالاتر از تمام علوم دیگر تشریح کند. کتاب وی در مورد این تئوری در سال 2009 تحت عنوان 'بیوسنتریسم: زندگی و آگاهی کلیدهای درک جهان' با همکاری باب برمن به چاپ رسید.
کتاب وی در مورد این تئوری در سال 2009 تحت عنوان 'بیوسنتریسم: زندگی و آگاهی کلیدهای درک جهان' با همکاری باب برمن به چاپ رسید. -
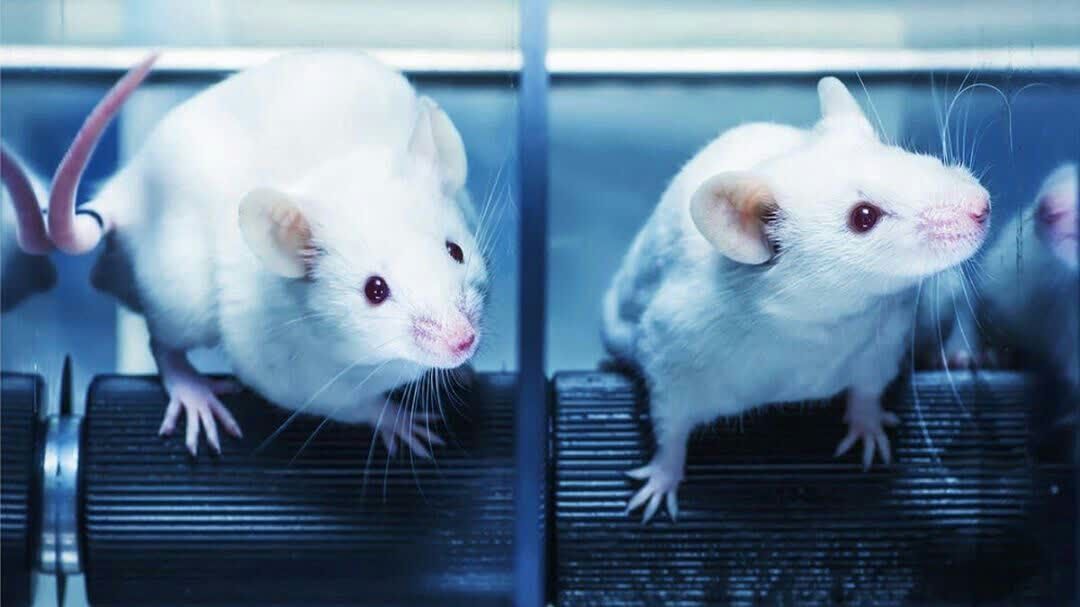
ایجاد مدل های حیوانی برای مطالعه بر روی کرونا ویروس پژوهشگران "دانشگاه ییل"(Yale University) آمریکا، عفونت ناشی از کروناویروس را روی موشها بررسی کردهاند و به آزمایش داروها و واکسنها روی آنها پرداختهاند. این پژوهش نشان میدهد که پروتئینهای ضد ویروسی مهم علاوه بر محافظت از ریهها، به جلوگیری آسیب بیشتر بافتها نیز منجر شوند. پژوهشگران باید مدلهای حیوانی مبتلا به کروناویروس را بررسی کنند تا بهتر از عهده درک این ویروس برآیند و گزینههای احتمالی را برای درمان و ابداع واکسن ارائه دهند. موشها نسبت به حیوانات دیگر بیشتر مورد استفاده پژوهشگران قرار میگیرند. اما موضوع در مورد بررسی کروناویروس متفاوت است زیرا این حیوانات نمیتوانند به کروناویروس مبتلا شوند. کروناویروس نمیتواند به پروتئین گیرنده موسوم به "ACE2" در موشها متصل شود که راه ورود ویروس به سلولها است.
پژوهشگران "دانشگاه ییل"(Yale University) آمریکا، عفونت ناشی از کروناویروس را روی موشها بررسی کردهاند و به آزمایش داروها و واکسنها روی آنها پرداختهاند. این پژوهش نشان میدهد که پروتئینهای ضد ویروسی مهم علاوه بر محافظت از ریهها، به جلوگیری آسیب بیشتر بافتها نیز منجر شوند. پژوهشگران باید مدلهای حیوانی مبتلا به کروناویروس را بررسی کنند تا بهتر از عهده درک این ویروس برآیند و گزینههای احتمالی را برای درمان و ابداع واکسن ارائه دهند. موشها نسبت به حیوانات دیگر بیشتر مورد استفاده پژوهشگران قرار میگیرند. اما موضوع در مورد بررسی کروناویروس متفاوت است زیرا این حیوانات نمیتوانند به کروناویروس مبتلا شوند. کروناویروس نمیتواند به پروتئین گیرنده موسوم به "ACE2" در موشها متصل شود که راه ورود ویروس به سلولها است. موشهایی که مورد مهندسی ژنتیکی قرار گرفتهاند تا نوع انسانی پروتئین ACE2 را داشته باشند، به کروناویروس مبتلا میشوند اما دسترسی به این گونه موشها محدود است و موجب میشود که پژوهشگران نتوانند تاثیر کروناویروس بر موشها را بررسی کنند. پژوهشگران دانشگاه ییل در این پروژه، یک مدل جایگزین از موشهای مبتلا به کروناویروس ابداع کردهاند که ژن انسانی ACE2 را در خود دارند.
موشهایی که مورد مهندسی ژنتیکی قرار گرفتهاند تا نوع انسانی پروتئین ACE2 را داشته باشند، به کروناویروس مبتلا میشوند اما دسترسی به این گونه موشها محدود است و موجب میشود که پژوهشگران نتوانند تاثیر کروناویروس بر موشها را بررسی کنند. پژوهشگران دانشگاه ییل در این پروژه، یک مدل جایگزین از موشهای مبتلا به کروناویروس ابداع کردهاند که ژن انسانی ACE2 را در خود دارند.
"آکیکو ایواساکی"(Akiko Iwasaki)، سرپرست این پژوهش و همکارانش دریافتند که کروناویروس میتواند در این موشها تکثیر شود و واکنش التهابی شبیه به واکنش بیماران مبتلا به کووید-۱۹ در آنها پدید آورد. بسیاری از سلولهای ایمنی طی این واکنش، فعال میشوند. ایواساکی گفت: موشهای مبتلا به کروناویروس، فورا پادتنهای خنثی کننده را برای مقابله با بیماری منتشر میکنند. وی افزود: موشهایی که ما برای این بررسی ارائه دادهایم، به صورت گسترده در دسترس قرار میگیرند و به ما کمک میکنند تا جنبههای مهم ابتلا به کووید-۱۹ و تکثیر کروناویروس را درک کنیم. این موشها، پلتفرمی حیاتی برای بررسی راهبردهای درمانی مقابله با کووید- ۱۹ به شمار میروند.
ایواساکی گفت: موشهای مبتلا به کروناویروس، فورا پادتنهای خنثی کننده را برای مقابله با بیماری منتشر میکنند. وی افزود: موشهایی که ما برای این بررسی ارائه دادهایم، به صورت گسترده در دسترس قرار میگیرند و به ما کمک میکنند تا جنبههای مهم ابتلا به کووید-۱۹ و تکثیر کروناویروس را درک کنیم. این موشها، پلتفرمی حیاتی برای بررسی راهبردهای درمانی مقابله با کووید- ۱۹ به شمار میروند. Reference: https://rupress.org/jem/article/217/12/e20201241/151999/Mouse-model-of-SARS-CoV-2-reveals-inflammatory
Reference: https://rupress.org/jem/article/217/12/e20201241/151999/Mouse-model-of-SARS-CoV-2-reveals-inflammatory
@دانش-آموزان-آلاء
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
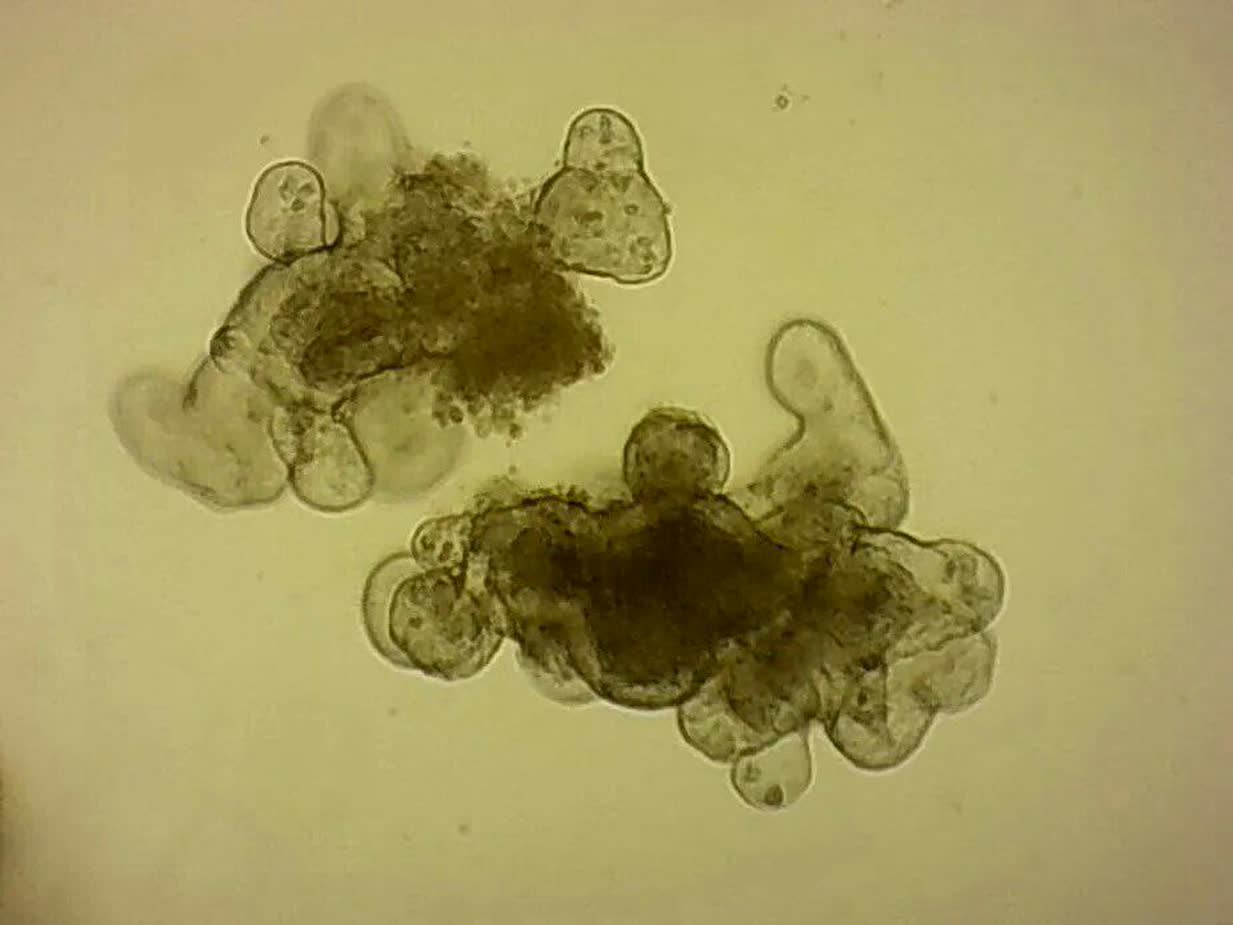
 تولید نسل جدیدی از ارگانوئیدهای روده انسانی بر روی تراشه
تولید نسل جدیدی از ارگانوئیدهای روده انسانی بر روی تراشه پژوهشگران "موسسه پلیتکنیک فدرال لوزان"(EPFL) سوئیس، نمونه کوچکی از روده انسان را روی یک تراشه ابداع کردهاند که شباهت نزدیکی به نحوه شکلگیری و ترکیب سلولی روده کوچک دارد.شاید این تراشه بتواند به پیشرفت پزشکی شخصیسازی شده و بررسی دارو کمک کند و حتی راه را برای پرورش بافتها و اندامهای جدید در آزمایشگاهها هموار سازد. برای به وجود آوردن انداموارهها معمولا از سلولهایی استفاده میشود تا بافتها و اندامهای جدید را شکل دهند اما روشهای کنونی در تقلید از بافتهای طبیعی انسان با محدودیتهایی رو به رو هستند و پژوهشگران هنوز نمیدانند که چگونه به کنترل و هدایت حرکت و رشد سلولها بپردازند.
پژوهشگران "موسسه پلیتکنیک فدرال لوزان"(EPFL) سوئیس، نمونه کوچکی از روده انسان را روی یک تراشه ابداع کردهاند که شباهت نزدیکی به نحوه شکلگیری و ترکیب سلولی روده کوچک دارد.شاید این تراشه بتواند به پیشرفت پزشکی شخصیسازی شده و بررسی دارو کمک کند و حتی راه را برای پرورش بافتها و اندامهای جدید در آزمایشگاهها هموار سازد. برای به وجود آوردن انداموارهها معمولا از سلولهایی استفاده میشود تا بافتها و اندامهای جدید را شکل دهند اما روشهای کنونی در تقلید از بافتهای طبیعی انسان با محدودیتهایی رو به رو هستند و پژوهشگران هنوز نمیدانند که چگونه به کنترل و هدایت حرکت و رشد سلولها بپردازند. پژوهشگران موسسه پلیتکنیک فدرال لوزان در جدیدترین تلاش خود، از یک قالب استفاده کردند که با کمک لیزر درون هیدروژل و در یک کانال ریزسیال ایجاد شده و میتواند سلولهای بنیادی را برای داشتن آرایش بافتی مناسب شبیه به روده کوچک هدایت کند. قالب هیدروژل، ساختارهایی مشابه ساختارهای موجود در روده به وجود میآورد. پژوهشگران در کمال شگفتی مشاهده کردند که سلولها به محض رسیدن به ساختارهای ایجاد شده، بدون نیاز به راهنمایی به سازماندهی خود پرداختند و به سلولهایی تبدیل شدند که در قسمتهای خاصی از روده یافت میشوند. شکل و ترکیب هیدروژل کافی بود که سلولها را ارتقا دهد تا مانند سلولهای روده عمل کنند.
پژوهشگران موسسه پلیتکنیک فدرال لوزان در جدیدترین تلاش خود، از یک قالب استفاده کردند که با کمک لیزر درون هیدروژل و در یک کانال ریزسیال ایجاد شده و میتواند سلولهای بنیادی را برای داشتن آرایش بافتی مناسب شبیه به روده کوچک هدایت کند. قالب هیدروژل، ساختارهایی مشابه ساختارهای موجود در روده به وجود میآورد. پژوهشگران در کمال شگفتی مشاهده کردند که سلولها به محض رسیدن به ساختارهای ایجاد شده، بدون نیاز به راهنمایی به سازماندهی خود پرداختند و به سلولهایی تبدیل شدند که در قسمتهای خاصی از روده یافت میشوند. شکل و ترکیب هیدروژل کافی بود که سلولها را ارتقا دهد تا مانند سلولهای روده عمل کنند. "ماتیاس لوتولف"(Matthias Lütolf)، از پژوهشگران این پروژه گفت: به نظر میرسد هندسه چارچوب هیدروژل با حفرههای اسرارآمیز خود، مستقیما رفتار سلولهای بنیادی را تحت تاثیر قرار میدهد تا بتوانند مانند بافت طبیعی باشند
"ماتیاس لوتولف"(Matthias Lütolf)، از پژوهشگران این پروژه گفت: به نظر میرسد هندسه چارچوب هیدروژل با حفرههای اسرارآمیز خود، مستقیما رفتار سلولهای بنیادی را تحت تاثیر قرار میدهد تا بتوانند مانند بافت طبیعی باشند "مایک نیکلایو"(Mike Nikolaev)، از پژوهشگران این پروژه گفت: سیستم ریزسیال به ما امکان داد تا این رودههای کوچک ایجاد کنیم و انداموارهای داشته باشیم که تعادل میان تولد و مرگ سلولها در آن برقرار شده است
"مایک نیکلایو"(Mike Nikolaev)، از پژوهشگران این پروژه گفت: سیستم ریزسیال به ما امکان داد تا این رودههای کوچک ایجاد کنیم و انداموارهای داشته باشیم که تعادل میان تولد و مرگ سلولها در آن برقرار شده است Reference:https://actu.epfl.ch/news/next-gen-organoids-grow-and-function-like-real-t-2
Reference:https://actu.epfl.ch/news/next-gen-organoids-grow-and-function-like-real-t-2
@دانش-آموزان-آلاء
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

 محلولی جدید برای فریز کردن سلول های بنیادی
محلولی جدید برای فریز کردن سلول های بنیادیمحلول STEM-CELLBANKER
 یک محلول با درجه GMP و فاقد DMSO است که از نظر شیمیایی تعریف شده است و همان طور که گفته شد فاقد DMSO به عنوان عامل ضد یخ است. این محلول برای مشتریانی تولید شده است که مایل نیستد محلول حفاظت انجمادی شان حاوی DMSO باشد زیرا عوارض ناخواسته ای را روی نمونه های می گذارد. این محلول مطابق با دستورالعمل های GMP مربوط به ژاپن، اروپا و آمریکا طراحی و تولید شده است. محلول STEM-CELLBANKER
یک محلول با درجه GMP و فاقد DMSO است که از نظر شیمیایی تعریف شده است و همان طور که گفته شد فاقد DMSO به عنوان عامل ضد یخ است. این محلول برای مشتریانی تولید شده است که مایل نیستد محلول حفاظت انجمادی شان حاوی DMSO باشد زیرا عوارض ناخواسته ای را روی نمونه های می گذارد. این محلول مطابق با دستورالعمل های GMP مربوط به ژاپن، اروپا و آمریکا طراحی و تولید شده است. محلول STEM-CELLBANKER برای فریز کردن سلول های بنیادی و سلول های iPS و هم چنین سلول های اولیه حساس طراحی شده است و قابلیت حمایت از انجامد ارگانوئیدها را دارد. هم چنین این کمپانی(AMSBIO)، محصول دیگری به نام HSC-BANKER
برای فریز کردن سلول های بنیادی و سلول های iPS و هم چنین سلول های اولیه حساس طراحی شده است و قابلیت حمایت از انجامد ارگانوئیدها را دارد. هم چنین این کمپانی(AMSBIO)، محصول دیگری به نام HSC-BANKER . را ارائه کرده اند که عاری از مشتقات جانوری و ... است و مناسب برای ذخیره سازی سلول های بنیادی خون ساز است.
. را ارائه کرده اند که عاری از مشتقات جانوری و ... است و مناسب برای ذخیره سازی سلول های بنیادی خون ساز است. Reference: https://www.clinicallabmanager.com/product-news/optimized-freezing-solutions-for-clinical-application-of-cell-therapy-products-23826
Reference: https://www.clinicallabmanager.com/product-news/optimized-freezing-solutions-for-clinical-application-of-cell-therapy-products-23826
@دانش-آموزان-آلاء
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470