سلول های بنیادی راهی به آینده
-

محققان در مطالعه ای جدید سعی در درمان شکلی از بیماری چشمی آمائوروزیس مادرزادی لبر(LCA) با استفاده از ژن درمانی داشته اند. این بیماری حاصل جهش های اتوزومی غالب در ژن CRX است. آن ها رویکردشان را با استفاده از بافت شبکیه تولید شده از سلول های بیمار در آزمایشگاه(ارگانوئیدهای شبکیه) تست کرده اند. این رویکرد شامل افزودن نسخه هایی از ژن طبیعی تحت یک مکانیسم ذاتا کنترل شده است که موجب احیای نسبی عملکرد CRX می شود. به عقیده محققین این ژن درمانی می تواند به طور بالقوه ای بیماری را درمان کند.
ژن CRX پروتئینی به همین نام را کد می کند که به DNA متصل می شود و به گیرنده های نوری چشم دستور می دهد که رنگ دانه های حساس به نور به نام اپسین(opsins) را تولید کنند. بدون پروتئین CRX دارای عملکرد، گیرنده های نوری توانایی شان برای تشخیص نور را از دست می دهند و در نهایت می میرند.
https://medicalxpress.com/pdf531037742.pdf
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
یک تیم از کالج پزشکی آلبرت اینشتین (نیویورک ، ایالات متحده آمریکا) نشان داده اند که استفاده موضعی از یک درمان مبتنی بر siRNA ، با هدف قرار دادن آنزیم fidgetin-like 2 (FL2) میتواند اعصاب موثر در سیستم نعوظ آسیب دیده در یک مدل موش را بازسازی و بازیابی کند.
نتایج منتشر شده این پژوهش در مجله JCI Insight حاکی از آن است که استفاده از این روش درمانی زندگی مردانی را که به دنبال پروستاتکتومی مبتلا به اختلال نعوظ (ED)شده اند را بهبود بخشد.
سرپرست این پژوهش، کلوین دیویس (از کالج پزشکی آلبرت انیشتین) اظهار داشت: "با وجود ظهور روشهای اصطلاحاً محافظت از عصب (پروستاتکتومی رادیکال)، می تواند به اعصاب عمقی که در عملکرد تنظیم جریان خون به آلت تناسلی نقش دارد، آسیب برساند." . "این بطوری است که تنها 30٪ از بیماران 18 ماه پس از عمل جراحی علایم بهبودی را نشان میدهند وحدودا 60٪ از آنها با توحه به آسیبهای وارد شده به اعصاب ناحیه، از قدرت نعوظ کافی برای مقاربت برخوردار نیستند."
این تیم تحقیقاتی قبلاً در پروژهای مشخص کرده بود که آنزیم FL2 مهاجرت سلولهای ترمیم کننده را به سمت زخمها کندتر میکند و به دنبال آن بهبود زخم را طولانی میکند. همچنین که آنها نشان داده بودند که استفاده از siRNA در مهار FL2 باعث بهبودی زخم و بازسازی بافت آسیب دیده در موشها میشود، اما تأثیر این روش درمانی بر روی اعصاب هنوز بررسی نگردید که در مطالعه حاضر به کاووش در این موضوع پرداختند.
لذا در این مطالعه ، آنها از دو مدل موشی استفاده کردند که در یک گروه اعصابهای عمقی دچار له شدگی و در گروه دیگر اعصاب قطع گردید تا آسیب مرتبط با پروستاتکتومی رادیکال را تقلید کند. این siRNA ، به شکل ژل ، بلافاصله پس از آسیب به اعصاب ناحیه مورد نظر تزریق شد..
در گروه موشهای دارای اعصاب له شده ، آزمایشهای کاوانوزومتری نشان داد که درمان siRNA بازسازی را افزایش داده و عملکرد اعصاب نعوظ را بازیابی کرده است. بطوریکه پس از یک ماه ، فشار خون درون شاخههای آلت تناسلی حیوانات با موشهای طبیعی قابل مقایسه بود.
در حیوانات دارای اعصاب قطع شده، بهبودی نسبی عملکرد عصب نعوظ وجود داشت و siRNA توانست شکافهای چند میلی متری بین انتهای عصب قطع شده را بهبود بخشد.
از پژوهشگران این مقاله، دیوید شارپ اظهار داشت: "از نظر عملکرد ، نتیجه درمان با siRNA معادل یا بهتر از پیوند عصب بود."
این گروه در حال حاضر در حال بررسی اثر روش siRNA در برابر آسیب عصبی بدنبال آسیب نخاعی هستند.
Doi: https://doi.org/10.1172/jci.insight.138484.
https://pubmed.ncbi.nlm.nih.gov/33872220/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
تیمی از موسسه هوبرخت (اوترخت ، هلند) اولین مدل ارگانوئید مشتق از بیمار را برای سرطان دهانه رحم ایجاد کرده اند. این سیستم جدید الگوی عالی برای مطالعه دهانه رحم انسان را فراهم می کند.
نتایج این پژوهش به تازگی در مجله Cell Stem Cell منتشر شده است.
ارگانوئیدها، کشت هایی از سلولهای بنیادی به صورت سه بعدی هستند که عملکرد یک اندام را تقلید می کنند. این تیم در مطالعه خود یک مدل مبتنی بر ارگانوئید برای دهانه رحم سالم و همچنین بدخیمیهای مرتبط از جمله سرطان دهانه رحم که اغلب توسط ویروسی به نام ویروس پاپیلومای انسانی (HPV) ایجاد می شود، ایجاد کرده اند.
سرپرست این پروژه، کدی لوموسار اظهار داشت: "در این مطالعه، از ویروس هرپس( ویروس هرپس سیمپلکس -1 (HSV-1)) به منظور نشان دادن پتانسیل این مدل برای تحقیق در مورد عفونت های مقاربتی استفاده گردید. همچنین سرطان دهانه رحم اغلب به دلیل عفونت HPV ایجاد میشود ، اما تحقیقات در مورد این ویروس پیچیده است زیرا بررسی ویروس در آزمایشگاه امری دشوار است. مدل جدید ما ممکن است بتواند این مانع را پشت سر بگذارد. ”
علاوه بر این، این تیم موفق به تولید توموروئیدها(ارگانوئیدهایی که از بافت سرطانی رشد کرده اند و از ویژگیهای سرطان دهانه رحم تقلید میکنند) شدند. لذا این تکنولوژی باعث میشود تا روش شیمی درمانی مناسب با بالاترین تاثیر برای بیمار تجویز گردد.
در پایان سرپرست این پروژه اذعان داشت"این امیدواری را داریم که این تکنولوژی منجربه تولید سریع بانکهای زیستی سرطان دهانه رحم مبتنی بر ارگانوئید در سراسر جهان شود تا روشهای جدیدی را برای پیشرفت تحقیقات در مورد بیولوژی دهانه رحم و بیماریهای مرتبط ارائه دهد. "
Link:https://www.regmednet.com/first-patient-derived-organoid-model-developed-for-cervical-cancer/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
یک آزمایش بالینی فاز II برای ارزیابی سلولهای بنیادی مزانشیمی بزرگسالان به عنوان یک درمان اصلاح کننده بیماری برای بیماری پارکینسون آغاز شده است. نتایج ایمنی و تحمل ، که در یک آزمایش قبلی ارزیابی شده بود ، اخیراً در ژورنال Movement Disorders منتشر شده است. مطالعه فاز I نشان داد که هیچ واکنش جانبی جدی در رابطه با تزریق سلول های بنیادی و هیچ واکنش ایمونولوژیکی به سلول ها ، که از مغز استخوان یک اهدا کننده بزرگسال سالم ناشی می شود ، وجود ندارد.
Mya Schiess ، استاد گروه مغز و اعصاب در مرکز علوم بهداشتی دانشگاه تگزاس در هوستون (TX ، ایالات متحده) :
"مطالعات نشان داده است که سلولهای بنیادی مزانشیمی می توانند با ترشح چندین مولکول ضد التهاب و فاکتور رشد که می توانند تعادل بافت را بازیابی کرده و مرگ عصبی را مختل کنند ، به مناطق آسیب دیده و به محیط پاسخ دهند. سلولهای بنیادی با سلولهای ایمنی ارتباط متقابل دارند ، و منجر به یک حالت ضد التهابی می شود که اجازه می دهد یک روند ترمیم انجام شود.بیماری پارکینسون دومین بیماری شایع تخریب عصبی است که بیش از یک میلیون آمریکایی به آن مبتلا هستند. این بیماری همچنین با رشد بیش از 60،000 مورد جدید هر ساله با سریعترین رشد در بین بیماری های تخریب کننده عصبی ایجاد می شود. پیش بینی می شود که تا سال 2040 ، بیماری پارکینسون 17.5 میلیون نفر در سراسر جهان را تحت تأثیر قرار دهد.
https://www.uth.edu/news/story.htm?id=39f08ac0-b3d0-476d-9ac4-e9c3527f1c94
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
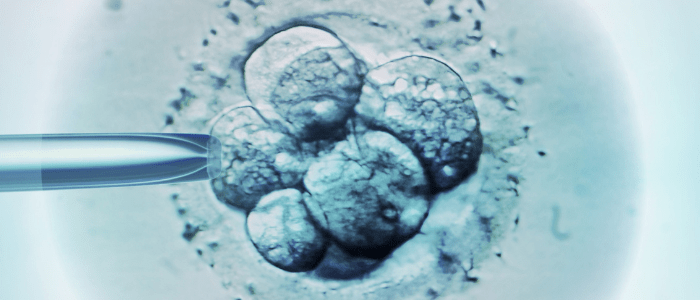
جنین های کایمریک انسان و میمون با استفاده از سلول های بنیادی ایجاد می شوند
محققان در چین و ایالات متحده آمریکا با ادغام سلول های بنیادی انسان در جنین های پستانداران ، با موفقیت رشد جنین های کایمریک را تا 20 روز افزایش داده اند. اگرچه این تحقیقات نگرانی های اخلاقی را ایجاد می کند ، اما این پتانسیل را دارد که بینش جدیدی در مورد زیست شناسی رشد و تکامل و رفع کمبود اعضای اهدا کننده ارائه دهد. این مطالعه در Cell منتشر شده است.توانایی رشد سلولها از یک گونه در ارگانیسم گونه دیگر ، ابزاری قدرتمند برای تحقیقات پزشکی ارائه می دهد. پیامدهای بالقوه گسترده ای است و می تواند درک ما را در تکوین انسانی ، پیشرفت بیماری ها و پیری بهبود دهد و بسترهایی برای ارزیابی دارو و پیوند اعضا فراهم کند.
نویسنده ارشد خوان کارلوس ایزپیسوا بلمونته ، استاد آزمایشگاه بیان ژن در موسسه علوم زیست شناختی سالک (کالیفرنیا ، ایالات متحده آمریکا). ، اظهار داشت: "از آنجا که ما قادر به انجام برخی از آزمایش ها بر روی انسان نیستیم ، ضروری است که مدل های بهتری برای مطالعه و درک دقیق زیست شناسی و بیماری های انسانی داشته باشیم." "یک هدف مهم از زیست شناسی تجربی ، توسعه سیستم های مدل است که امکان مطالعه بیماری های انسان را در شرایط in vivo فراهم می کند."
در این مطالعه ، تیم تحقیقاتی سلولهای بنیادی پرتوان انسان را با یک پروتئین فلورسنت برچسب گذاری کرده و آنها را به جنین های ماکا 6 روزه تزریق کردند. آنها مشاهده کردند که سلول های بنیادی انسان نسبت به آزمایش های قبلی با استفاده از بافت خوک زنده مانده و با کارایی نسبی بهتری ادغام می شوند.
درک بیشتر ارتباطات مولکولی در ارگانیسم های کایمریک می تواند نگاهی بی سابقه به محققان در مراحل اولیه رشد انسانی داشته باشد. همچنین می توان از ارگانیسم های کایمریک برای تولید سلول ها و اندام هایی برای پیوند در گونه های میزبان استفاده کرد که به دلایل مختلف مناسب ترند. علاوه بر این ، این ارگانیسم ها می توانند بستر جدیدی برای مطالعه چگونگی پیدایش بیماری های خاص و همچنین آزمایش اثربخشی ترکیب دارویی فراهم کنند ، زیرا مدل های کایمریک ممکن است نتایج مطلوب تری در پاسخ های سلول های انسانی نسبت به دارو نشان دهند.
یک پیش نمایش همراه در Cell ملاحظات اخلاقی پیرامون این مطالعه
خاطرنشان می کند که "این وظیفه ما دانشمندان است که تحقیقات خود را با پیروی از تمام دستورالعمل های اخلاقی ، قانونی و اجتماعی انجام دهیم." قبل از شروع این کار ، "مشاوره ها و بررسی های اخلاقی هم در سطح نهادی و هم از طریق ارتباط با متخصصان اخلاق زیستی غیر وابسته انجام می شد. این فرایند دقیق به راهنمایی ما در انجام آزمایش ها کمک کرد. "https://www.regmednet.com/human-monkey-chimeric-embryos-created-using-stem-cells/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

فناوری CRISPR به انقلابی در ژن درمانی کمک می کند
محققان موسسه ملی بهداشت (MD ، ایالات متحده) و دانشگاه هاروارد (MA ، ایالات متحده) از نسل دوم ویرایش ژن CRISPR با عنوان "ویرایش پایه" برای ایجاد انقلابی در ژن درمانی برای مقابله با یک اختلال ژنتیکی به نام هاچینسون-گیلفورد که منجر به سندرم پروگریا (HGPS)می شود، استفاده کرده اند.
نتایج آنها ، که در فیبروبلاستهای کشت یافته و موشها آزمایش شده است ، در Nature منتشر شد.
HGPS به طور معمول توسط جهش C-G به T-A در ژن LMNA ایجاد می شود. این جهش منجر به تولید پروتئین سمی معروف به پروگرین می شود که باعث پیری سریع می شود و طول عمر کودکان مبتلا به پروژریا را تقریباً به 14 سال می رساند.
در این مطالعه ، محققان از یک ویرایشگر بر پایه آدنین برای اصلاح مستقیم جهش HGPS بیماریزا در هر دو فیبروبلاست کشت مشتق شده از کودکان مبتلا به پروگریا و در مدل موش HGPS استفاده کردند.ین تیم برای رساندن ویرایشگر پایه آدنین به فیبروبلاست های کشت شده از روش زایمان ویروس استفاده کردند. طبق مطالعه آنها ، این منجر به اصلاح 87-91٪ آلل بیماریزا ، کاهش بهم پیوستگی غلطRNA ، کاهش سطح پروگرین و اصلاح ناهنجاریهای هسته ای می شود. آنها هیچ ویرایشی خارج از هدف را در این فیبروبلاست های مشتق شده از بیمار تشخیص ندادند.
محققان در مطالعه خود نتیجه گرفتند: "این یافته ها با اصلاح مستقیم علت اصلی بیماری ها ، ویرایش in vivo را به عنوان یک درمان احتمالی برای HGPS و سایر بیماری های ژنتیکی نشان می دهد."
https://www.regmednet.com/new-crispr-technology-helps-revolutionize-gene-therapy/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
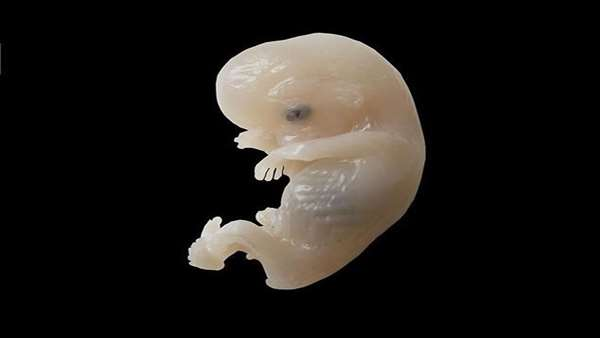
فرصت انسانها برای مطالعه بر روی اشکال اولیه جنین بسیار کم است، زیرا جنین بعد از شکلگیری به سرعت رشد کرده و تکامل مییابد. اما پژوهشگران با مدل سازی جنین در ابتدای شکلگیری میتوانند بر روی موضوعات مهمی مانند ناباروری و بیماریهای مادرزادی تحقیق کنند.
جنین اولیه ای که با استفاده از سلولهای پوست تولید شده ساختار و جزئیات کاملی دارد و از آن میتوان برای مطالعه بر روی عوامل مختلفی که شکلگیری انسانها در جنین مادر را تحت تأثیر قرار میدهند، استفاده کرد. مدل سه بعدی تولید شده از جنین اولیه متشکل از لایه درونی و یک لایه حفاظتی بیرونی است.
با توجه به محدودیتهای حقوقی و اخلاقی در زمینه مطالعه بر روی جنین نوزادان، این مدل سازی تحقیق بر روی جنبههای مختلف بارداری در محیط آزمایشگاهی را نیز تسهیل میکند. همچنین به این شیوه میتوان بر روی ویژگیهای ژنتیکی جنین که بر روی رفتار انسانها تأثیر میگذارد نیز مطالعاتی را نیز انجام داد. برای طراحی این جنین سلولهای پوست انسان در درون یک داربست زیستی ژله ای قرار گرفت و بلوکهای سازنده بلاستوسیست نیز به آن اضافه شد. البته این جنین فاقد غشای خارجی جنین طبیعی موسوم به زون پلوسیدا است و بعد از چند روز تکامل متوقف شده و از کار میافتد، ولی فعالیت ۱۴ روزه آن برای انجام مطالعات مد نظر محققان کافی است.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
با جراحی بازساختی آشنا شویم
فناوری سلولهای بنیادی و پزشکی بازساختی به طور فزایندهای نقش خود را در ارتقای سلامت و درمان پررنگ میکند و کارایی تازهای از خود نشان میدهد.ترمیم عارضههای ارتوپدی، پوستی و کمک به درمان بسیاری از بیماریها یکی از کاربردهای فناوری سلولهای بنیادی و پزشکی بازساختی به شمار میرود که با پیشرفت تجهیزات و روشهای درمانی ویژه، بیش از گذشته اثربخش و کارآمد شده است.
جراحی بازساختی یکی از روشهای فناورانه مبتنی بر پزشکی بازساختی، آسیبهای ناشی از بیماری و مشکلات مادرزادی را برطرف میکند و این نوع جراحی، با جراحی زیبایی متفاوت است زیرا با هدف درمانی انجام می شود.
جراحی بازساختی قسمتهایی از بدن را که دچار نواقص یا عارضههایی هستند یا تحت تاثیر بیماریها دچار آسیب شده است ترمیم میکند. بازساختی در این روش به معنای ترمیم عارضه ناشی از آسیب یا تخریب چیزی است.
نقش سلول های بنیادی پس از جراحی
درمان به کمک سلول های بنیادی یکی از مهمترین پیشرفتها در فناوریهای پزشکی به شمار میرود. این روش درمانی از توانایی ترمیمی بدن شما برای سرعت بخشیدن به بهبودی از طریق بازسازی سلول استفاده می کند. بهبود درد و زمان بهبودی کوتاهتر پس از عمل جراحی از مزایای درمان به کمک سلولهای بنیادی است.
جراحیهای زانو، شانه و سایر جراحی های ارتوپدی به زمان بهبودی قابل توجهی نیاز دارند و گاهی اوقات جراحی اجتناب ناپذیر است. امروزه پیشرفت در پزشکی بازساختی می تواند زمینهای فراهم کند تا بدن پس از جراحی با استفاده از توانمندی سلولها دوباره بهبود یابد.
درمان و سلولهای بنیادی
همه افراد سلولهای بنیادی را در سراسر بدن خود دارند. این ماده اولیه توانایی تبدیل شدن به انواع مختلف سلول را دارد. این ویژگی، سلول های بنیادی را منحصر به فرد می کند و به توانایی آن در تسریع بهبود و بهبودی از جراحی کمک می کند.
سلول های بنیادی درمانی یک درمان کم تهاجمی است که در طول آن، سلولهای سالم با سلول های آسیب دیده جایگزین میشوند و همین موضوع باعث میشود سرعت بهبود افزایش یابد و علائم آسیب با سرعت بیشتری برطرف شود.
انواع مختلفی از سلول های بنیادی وجود دارد. سلول های بنیادی مزانشیمی در درمان های ارتوپدی موثرترین سلول ها هستند. این سلول های بنیادی توانایی بالایی در ترمیم بافت اسکلتی عضلانی مانند غضروف و استخوان دارند.
سلولهای بنیادی مزانشیمی بیشتر در مغز استخوان یافت می شوند. این سلول های تخصصی می توانند تکثیر و به انواع دیگر سلولها از جمله استخوان، عضله و غضروف تبدیل شوند. هنگام تزریق سلول ها به بدن کمک می کنند تا بافت ناحیه آسیب دیده را بازسازی کند.
آسیب ها و شرایط مزمن که بر سیستم اسکلتی عضلانی تأثیر می گذارد نه تنها دردناک است، بلکه اغلب فعالیت های روزمره را محدود می کند. هنگامی که برای ترمیم و بازیابی عملکرد اسکلتی عضلانی جراحی ضروری است.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
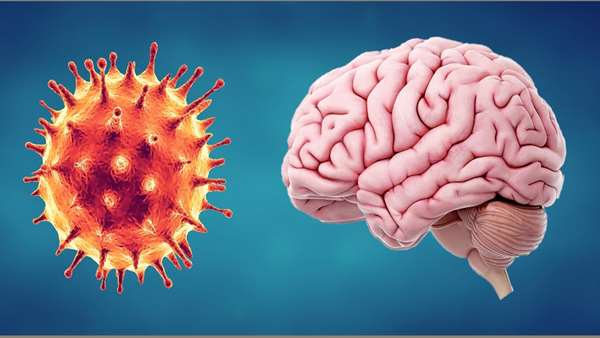
اگرچه COVID-19 را بدوا یک بیماری تنفسی می شناسند، اما SARS-CoV-2 می تواند سایر سایر اندام های بدن از جمله سیستم عصبی مرکزی را نیز تحت تاثیر قرار دهد و منجر به علایم مختلفی از سردرد گرفته تا از دست رفتن چشایی و بویایی و سکته و خونریزی مغزی شود.
در پژوهشی جدید دکتر ایوازاکی و همکارانش توانایی SARS-CoV-2 برای تهاجم به ارگانوئیدهای مغزی مشتق از سلول های بنیادی انسانی را مورد آنالیز قرار دادند. محققین دریافتند که این ویروس می تواند نورون های موجود در این ارگانوئیدها را آلوده کند و از ماشین سلولی برای همانندسازی و تکثیر استفاده کند. به نظر می رسد که ویروس می تواند با تقویت متابولیسم سلول های آلوده، همانندسازی خودش را نیز افزایش دهد و این در حالی است که نورون های پیرامونی غیر آلوده به دلیل این که منبع اکسیژن شان کاهش می یابد، می میرند. به این ترتیب یک ایسکمی و مرگ سلولی موضعی در مغز اتفاق می افتد که عوارض شدیدی را برای فرد مبتلا ایجاد می کند. این مطالعه می تواند منجر به یافتن درمان برای علایم عصبی مختلف مربوط به بیماری COVID-19 شود.
https://jvi.asm.org/content/95/10/e00140-21
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
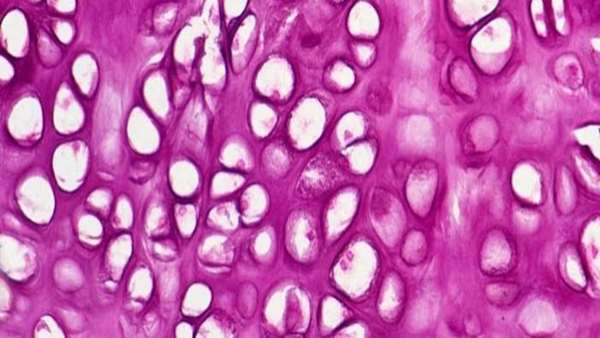
اخیراً تیم تحقیقاتی به سرپرستی دانشگاه علوم پزشکی استنفرد، مسیری برای رشد مجدد غضروف در بیماران مبتلا به آرتروز کشف نمودند. این پژوهش به دنبال مطالعات پیشین این تیم تحقیقاتی به منظور جداسازی سلول های بنیادی اسکلتی صورت پذیرفت و در مجله Nature Medicine به چاپ رسید.
چارلز چان از دانشگاه استنفورد اظهار داشت: "غضروف ها در بزرگسالی عملاً توانایی احیا ندارند و به دنبال آسیب به این بافت احیا آن با دشواری همراه است"
اما علیرغم این تصور عمومی که در سنین بالا این احیا صورت نمی پذیرد، محققین دانشگاه استنفرد توانسته اند با استفاده از روش میکروکاتالاژ و جهت دهی این ترمیم به سمت ایجاد بافت غضروفی، این احیا را در موش های مسن ممکن سازند.
غضروف آسیب دیده با استفاده از تکنیکی که شامل سوراخ کردن سوراخهای ریزی در سطح مفصل است ، قابل ترمیم است. این سوراخ های کوچک به عنوان میکرو شکستگی شناخته می شود و باعث می شود بدن بافت جدیدی در مفصل ایجاد کند.
محققین با آگاهی از اینکه سلول ها قبل از تبدیل شدن به استخوان از یک مرحله غضروف عبور می کنند ، از پروتئین مورفوژنتیک استخوان 2 (BMP2) برای شروع استخوان سازی پس از میکرو شکستگی استفاده کردند. سپس در میانه این فرایند استخوان سازی، با استفاده از فاکتور رشد اندوتلیال عروقی (VEGF)، این فرانید را متوقف کردند تا سلول های غضروفی حاصل شود.
در ادامه چان توضیح داد: "آنچه در نهایت به آن رسیدیم ، غضروفهایی بود که از سلولهای مشابه غضروف طبیعی با خواص مکانیکی قابل مقایسه ساخته شده است. با این وجود این ساختارها موجب احیای غضروف و به دنبال آن کاهش درد به میزان قابل توجهی را در موشهای مسن به دنبال داشت"
در ادامه این طرح محققان با انتقال بافت انسانی به موش ها توانستند نشان دهند سلول های اسکلتی انسان نیز می توانند به سمت رشد استخوان هدایت شوند و با استفاده از فاکتور رشد در مرحله غضروف متوقف شوند.
مرحله بعدی این تحقیق انجام آزمایشات مشابه در حیوانات بزرگتر قبل از اقدام به آزمایشات بالینی است.
مایکل لانگاکر (دانشگاه استنفورد) همچنین خاطرنشان کرد که اجزای اصلی به کار رفته در این مطالعه هر کدام به صورت جداگانه اعم از BMP2 و VEGF دارای تاییدیه ها FDA هستند. در صورت موفقیت این پژوهش در فاز بالینی میتوان امیدوار بود تا سریع تر به عنوان یک راهکار درمانی مورد تایید قرار بگیرد.
Link: https://www.regmednet.com/researchers-develop-method-to-regrow-cartilage-in-arthritic-mice/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
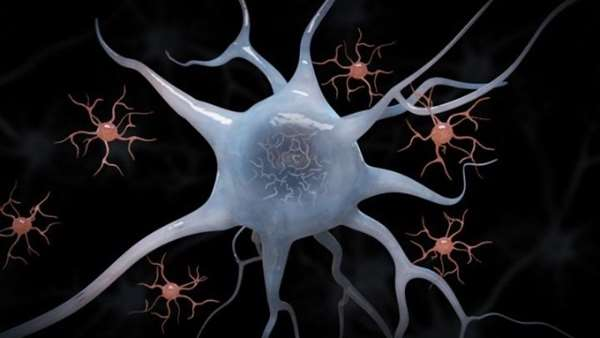
این حال، اغلب این تلاش ها مانند استفاده از رویکرد متداول پیوند مغز استخوان، به دلیل کارایی پایین جایگزینی این سلول ها با شکست مواجه شده است.
در مطالعه صورت گرفته در دانشگاه فودان چین، محققین استراتژی های موثری را برای جایگزینی میکروگلیاها پیشنهاد کرده اند که شامل جایگزینی میکروگلیاها بوسیله پیوند مغز استخوان(mrBMT)، جایگزینی میکروگلیاها بوسیله خون محیطی(mrPB) و جایگزینی میکروگلیاها بوسیله پیوند میکروگلیاها(mrMT) است.
نتایج نشان داده است که جایگزینی میکروگلیاها با مغز استخوان و خون محیطی به سلول های شبه میکروگلیا اجازه می دهد که میکروگلیاهای موجود در سیستم عصبی مرکزی را به طور موثری جایگزین کنند. از طرف دیگر استفاده از پیوند میکروگلیا موجب جایگزینی این سلول ها در نواحی مغزی مد نظر می شود.
Reference: https://medicalxpress.com/news/2020-08-scientists-malfunctioning-vacuum-cleaner-cells.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
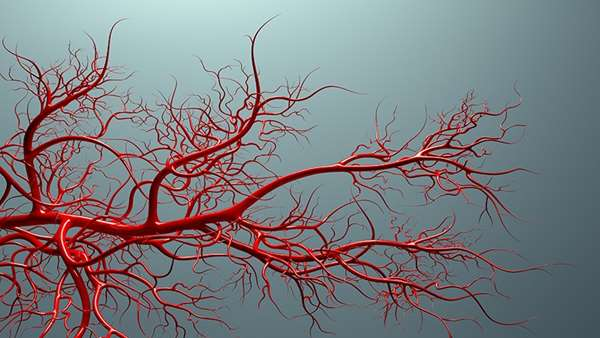
تولید سلول های پیش ساز عروقی القا شده(iVPCs)، به عنوان انقلابی در درمان بیماری های عروقی ایسکمیک معرفی شده اند. این سلول های پیش ساز عروقی القا شده را می توان با استفاده از فاکتورهای رونویسی موسوم به ETS(E-twenty six)، Etv2 و Fli1 تولید کرد. این سلول ها که حاصل تبدیل مستقیم رده ای هستند و طی کشت های طولانی مدت و در مقیاس وسیع به سلول های سرطانی تبدیل نمی شوند و به همین دلیل می توان آن ها را منبع سلولی مناسبی برای تولید عروق خونی مورد نیاز برای بافت های انسانی پرینت شده سه بعدی مانند قلب و کبد در نظر گرفت.
محققین نشان داده اند که پیوند iVPCs به مدل جانوری ایسکمی اندام حرکتی عقبی موجب تقویت جریان خون می شود و این در حالی است که هیچ توموری شکل نمی گیرد و به همین دلیل می توان آن ها را ابزار درمانی مناسبی برای درمان بیماری های عروقی ایسکمیک در نظر گرفت.
Reference: https://www.ahajournals.org/doi/10.1161/ATVBAHA.119.313684
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
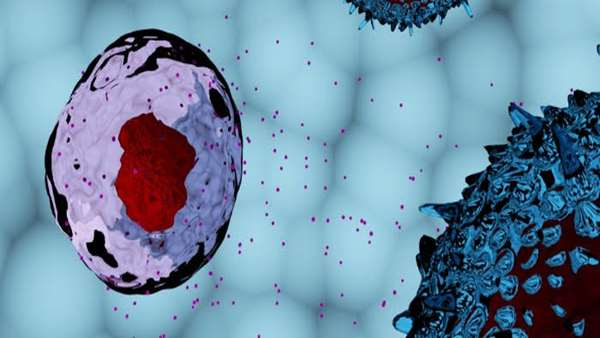
زخم های ایسکمیک در مدل های پیش بالینی با استفاده از یک محصول سلولی تولید شده توسط کلینیک مایو (MN ، ایالات متحده آمریکا) و با پوستی عاری از اسکار طبیعی بهبود یافته است. نتایج پژوهش این تیم که در مجله Theranostics منتشر شده است ، ترمیم یکپارچگی پوست ، فولیکول های مو ، غدد عرق ، ایجاد لطافت پوستی و آبرسانی طبیعی را نمایان ساخت و بستری را برای مطالعات در فاز بالینی، با استفاده از محصول اگزوزومال خالص (PEP) برای بهبود در بیماران را ممکن ساخت.
زخم های ایسکمیک مزمن در بین افراد مبتلا به بیماری هایی مانند دیابت ، زخم های فشار ، تصلب شرایین ، آسیب تروماتیک یا عوارض جانبی پرتودرمانی شایع است. در حالی که درمان های استاندارد فعلی پانسمان زخم ، ژل های موضعی و جراحی تا حدودی تسکین دهمده می باشد، اما آنها اغلب نمی توانند زخم را به طور کامل ببندند. در نتیجه ، تقریباً 7 میلیون نفر در ایالات متحده آمریکا زخم های غیر قابل ترمیم را تجربه می کنند.
در این مطالعه ، محققان در کلینیک مایو اثرات محصول اگزوزومی خالص ، مشتق شده از پلاکت شامل وزیکول های خارج سلولی را که بافت آسیب دیده را هدف قرار می دهند ، بر روی مدل های حیوانی بررسی کردند که در آن زخم هایی با خونرسانی کم تکرار شده است.
"ما دریافتیم که درمان مبتنی بر اگزوزوم توانایی تقویت بازسازی رگ های خونی در بافت های آسیب دیده را دارد. بدون درمان ، زخم های ایسکمیک مزمن بزرگتر و مشکل سازتر می شوند. ”
این محصول تحت اقدامات دقیق کنترل کیفیت تولید شده و بصورت پودر خشک برای ذخیره سازی طولانی مدت در دمای اتاق فرموله می شود. هنگام استفاده ، پودر با محلول هیدروژل در محل مخلوط می شود و می تواند مستقیماً روی زخم قرار گیرد.
استیون موران ، جراح پلاستیک کلینیک مایو و یکی از نویسندگان ارشد این مطالعه ، خاطرنشان کرد که زخم ها تنها با یک بار استفاده از اگزوزوم بهبود می یابند. "من متعجب شدم که این محصول پوست سالم را با خواص بیومکانیکی طبیعی (و نه بافت اسکار ) دوباره تولید می کند. از آنجا که این فناوری در حال حاضر برای کاربردهای بالینی مقیاس پذیر و بیومار ساخته شده است ، امکان پیشرفت عظیم در علم پزشکی و زمینه جراحی پلاستیک را ایجاد می کند. "
لذا این مطالعه بستری برای ورود به مطالعه به دریافت مجوز FDA را فراهم نموده است.
Link: https://www.regmednet.com/purified-exosomal-product-triggers-wound-healing-in-preclinical-model/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
یکی از مراحل کلیدی تومورزایی، مکانیک شروع ایجاد سلول های توموری است که سرنوشت سرطانی شدن آن ها را تعیین می کند. این سلول ها معمولا در سطح تنظیم ژن و از طریق تحقیق روی ژن های سرکوب کننده تومور MYC، p53 یا KRAS مورد بررسی قرار گرفته اند. تغییرات متابولیک درون سلول های توموری یکی از دلایل سرطانی شدن است ولی دلیل نامیرا شدن این سلول های توموری مشخص نیست. در مطالعات صورت گرفته روی مدل مگس سرکه(Drosophila melanogaster)، محققین یک زمان مشخص و دقیق را مشاهده کردند که در آن سلول های شروع کننده تومور نامیرا می شوند و از نظر ژنتیکی دستخوش تغییرات می شوند. آن ها سلول های بنیادی توموری مدل دروزفیلا را مورد استفاده قرار دادند و یک ژن سرکوب کننده تومور موسوم به Brat را حذف کردند. با استفاده از این مدل، محققین به بررسی این امر پرداختند که آیا متابولیسم نقش فعالی را در نامیرایی سلول های توموری Brat بازی می کند یا خیر. یافته های بدست آمده از دروزوفیلا در ادامه در مورد سلول های انسانی بکار گرفته شد. مشاهده شد که تومورهای Brat بسیار اکسیداتیو هستند و نرخ مصرف اکسیژن آن ها در مقایسه با سلول های طبیعی بالاتر بود. این یافته بسیار جالب بود زیرا تصور همگان بر این است که تومورها بسیار گلیکولیتیک هستند.
بنابراین به نظر می رسد که متابولیسم اکسیداتیو که در آن مسیر انرژی زایی وابسته به اکسیژن میتوکندریایی دخیل است، نقش کلیدی را در نامیرایی سلول های توموری بازی می کند. در طی شروع تومورزایی، غشاهای میتوکندریایی ادغام می شوند. این تغییر بزرگ در ریخت میتوکندری ها منجر به افزایش کارایی فسفریلاسیون اکسیداتیو می شود که دلیل سطح افزایش یافته NAD+ و NADH در سرطان است که معمولا در سرطان مشاهده می شوند. به عقیده محققین فسفریلاسیون اکسیداتیو افزایش یافته و متابولیسم NADH/NAD+ افزایش یافته ناشی از ادغام غشاهای میتوکندریایی عامل اصلی در شروع نامیرا شدن سلول های توموری است.
Reference:https://linkinghub.elsevier.com/retrieve/pii/S0092867420309478
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
استفاده از فناوری CRISPR برای تولید مدل لوکمیای میلوئید حاد(AML)
در حالی که داروهای متعدد جدیدی در سال های اخیر برای این عارضه شناسایی شده اند اما تنها قادر بوده اند روی علایم بیماری و میزان بقای بیماران تاثیر گذار باشند. تیمی از محققین در دانشکده پزشکی Icahn مونت سینای اولین مدل سلولی را با استفاده از فناوری سلول های بنیادی پرتوان القایی(iPSCs) و فناوری ویرایش ژنومی CRISPR برای نشان دادن تکامل لوکمیای میلوئید حاد از مراحل شروع تا مراحل پیشرفته را تولید کرده اند.
با استفاده از فناوری های ویرایش ژن برای تغییر ژن هایی که موجب بدخیمی سلولی می شوند، محققین توانسته اند اهداف درمانی بالقوه ای را برای مراحل اولیه بیماری شناسایی کنند. به طور ویژه به نظر می رسد که مسیرهای التهابی و ایمنی ذاتی می توانند اهداف اولیه ای برای مقابله با لوکمیای میلوئید حاد باشند و مهار آن ها می تواند به میزان شگفت آوری روی بقا و سلامت بیماران اثر بگذارد.
https://medicalxpress.com/pdf532149729.pdf
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
کمپلکس های پلی کامب، گروهی از پروتئین ها هستند که الگوهای بیان ژن را از طریق تنظیم ساختار DNA و پروتئین ها در سلول در حین تکوین اولیه حفظ می کنند. این کمپلکس ها نقش حیاتی را در سرکوب ژن یا خاموش کردن ژن های منفرد بازی می کنند تا به کنترل پاسخ ها طی تغییرات محیطی به محرک ها کمک کنند.
محققین در این پژوهش جدید دریافته اند که کمپلکس های پلی کامب PRC1 و PRC2 هر کدام نقش مهمی را در تنظیم الگوهای بیان ژنی و تکوین مناسب پوست بازی می کنند. در این مطالعه که برای مطالعه کمپلکس های پلی کامب در پوست موش صورت گرفت، حذف هر کدام از دو کمپلکس مذکور به تنهایی منجر به اختلال در عملکرد سدی پوست نشد و تنها مقداری از ضخامت پوست کاسته شد. اما زمانی که هر دو کمپلکس PRC1 و PRC2 حذف شدند، نواقص شدیدی بروز کرد که مهم ترین آن ها نازک شدن بیش از اندازه اپی درم پوست و از بین رفتن لایه های ضروری برای بقای جانور بود. محققین در این مطالعه دریافته اند که PRC1 و PRC2 به حفظ عملکرد تنظیم شده سرکوب ژن بویژه فاکتورهای رونویسی ضروری برای تشکیل بافت های غیر پوستی دخیل هستند و به نظر می رسد که عملکرد کمپلکس های پلی کامب برای تکوین مناسب پوست بسیار حیاتی باشد.
REFERENCES: https://medicalxpress.com/news/2021-02-mechanisms-essential-proper-skin.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

انستیتوی ملی بهداشت ایالات متحده آمریکا در تاریخ 16 آوریل اعلام کرد که در حال لغو محدودیت های تحقیقات مربوط به بافت جنین است که توسط دونالد ترامپ رئیس جمهور سابق انجام شده است.
بافت جنین به یک موضوع سیاسی در پزشکی تبدیل شده است زیرا بیشتر اوقات در هنگام سقط جنین از آن استفاده می شود. چنین بافتهایی برای تحقیق در مورد همه چیز از ویروس شناسی تا مغز در حال رشد بسیار موثر بوده است. از سلولهای جنینی نیز برای ایجاد روشهای درمانی برای انواع بیماریها از جمله بیماری پارکینسون ، Zika ، HIV و حتی COVID-19 استفاده شده است. آنتی بادی درمانی بصورت مونوکلونال که ترامپ هنگام بستری شدن در بیمارستان دریافت کرد نیز با استفاده از بافتهای جنینی توسعه یافته بود.
در سال 2019 ، ترامپ NIH را از بودجه کار دانشمندان دولتی که به بافت جنین متکی بودند ، ممنوع کرد. در حالی که این ممنوعیت به آزمایشگاه های غیر دولتی مانند آزمایشگاه های دانشگاه تسری پیدا نکرد ، این دستور محدودیت های جدیدی را برای کار آنها اعمال کرد. واشنگتن پست در آن زمان گزارش داد ، پیشنهادات و قراردادهای اعطایی به NIH که قصد استفاده از بافت جنین را داشتند ، تحت یک لایه اضافی بررسی اخلاقی در قالب یک هیئت مشاوره مملو از مخالفان سقط جنین قرار گرفتند. هیئت مدیره ، که در ماه اوت گذشته فقط یک بار تشکیل جلسه داد ، از 14 پیشنهادی که بررسی کرد ، 13 پیشنهاد را رد کرد.
حال دولت بایدن با عقب نشینی از این تصمیم، محدودیت های مطالعاتی بر روی این موضوع را تا حد بسیار زیادی کاهش داده است.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
زمانی که ما قصد تمرکز کردن روی چیزی داریم و یا در زمان فعالیت های هوشیارانه، هسته ساقه مغزی به آزادسازی ماده شیمیایی به نام نوراپی نفرین می پردازد. استفاده حاد از الکل موجب مهار این سیگنال در مغز می شود. در واقعی زمانی که برای انجام یک فعالیت نیاز به تمرکز داریم، نور اپی نفرین بوسیله ساختاری مغزی به نام locus coeruleus ترشح می شود.
محققین در این مطالعه نشان داده اند که نوراپی نفرین به گیرنده هایش روی سلول هایی به نام گلیای برگمن متصل می شود و این امر موجب افزایش سطح کلسیم درون سلول ها می شود. گلیاهای برگمن؛ آستروسیت های موجود در مخچه و در مجاور ساقه مغز هستند. نوراپی نفرین در پستانداران به طور مستقیم به گیرنده ها روی گلیای برگمن متصل می شود و به دنبال آن افزایش سطح کلسیم را فعال می کند. به عقیده محققین در افراد الکلی افزایش کلسیم در گلیای برگمن مهار می شود و فرد قدرت تسلط بر اعمال حرکتی و تمرکز ذهنی اش را از دست می دهد.
https://news.uthscsa.edu/drinking-blocks-a-chemical-that-promotes-attention/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
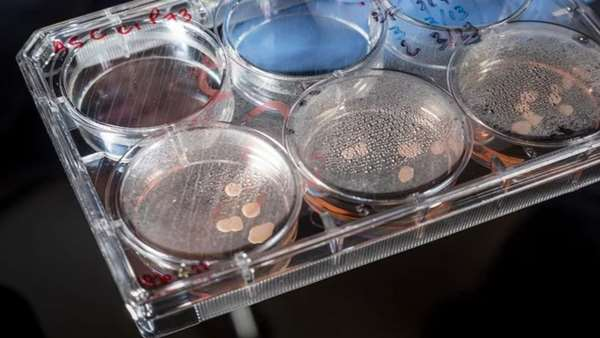
محققان در مطالعه ای جدید یک آنالیز ژنتیکی گسترده را روی ارگانوئیدهای مغزی مشتق از سلول های بنیادی که نزدیک به 20 ماه در آزمایشگاه کشت داده شده بودند انجام دادند.
نتایج نشان داد که این ارگانوئیدهای سه بعدی از یک ساعت داخلی تبعیت می کنند که بلوغ آن ها را طبق زمان بندی با تکوین انسانی هدایت می کند. تاکنون هیچ فرد یا مطالعه ای نتوانسته بود این ارگانوئیدها را به این مدت و با این دقت مورد کشت و آنالیز قرار دهد و این مطالعه برای اولین بار نشان داده است که ارگانوئیدهای مغزی مشتق شده از سلول های بنیادی پرتوان القایی می توانند به خوبی از مراحل تکوینی مغز تبعیت کنند. رسیدن به این نتیجه می تواند اطمینان محققین برای استفاده از این ارگانوئیدها در مطالعات تکوینی، غربالگری های دارویی و ... بسیار افزایش دهد.
Reference: https://www.nature.com/articles/s41593-021-00802-y
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

اگرچه ویروس های مرتبط با آدنو (AAV) به طور گسترده ای به عنوان یک راهکار امیدوار کننده برای ژن درمانی در بافت های معیوب در بدن انسان در نظر گرفته می شوند، اما هنوز راه طولانی برای پیشروی آنها وجود دارد تا بتوانند به عنوان محصولات موثر در انتقال ژن ، از پتانسیل کامل خود استفاده کنند. به همین منظور، محققان Dyno Therapyics با همکاری Google Research ، موسسه Harvard’s Wyss و دانشکده پزشکی هاروارد)، با رویکرد یادگیری ماشین طیف متنوعی از کپسیدهای AAV را تولید کردند.
این مطالعه که در Nature Biotechnology منتشر شده است ، کاربرد این روش را در شناسایی توسط سیستم ایمنی به طور خاص بر روی بافت آسیب دیده نشان می دهد.
دو چالش عمده استفاده از AAV به عنوان وسیله ای برای درمان ژن این است که کپسیدهای AAV که در حال حاضر استفاده می شوند ، در توانایی هدف گیری خاص بافت های معیوب محدود هستند و سیستم ایمنی بدن بیماران اغلب قادر به تولید آنتی بادی های خنثی کننده است که مانع از انتقال محصولات ژنتیکی از AAV ها می شود.
تخمین زده می شود که حداکثر 50-70٪ از جمعیت انسانی نسبت به اشکال طبیعی ناقلین AAV که در حال حاضر برای انتقال ژن درمانی استفاده می شود ، مصونیت دارند. محققان امیدوارند که از طریق مهندسی افزایش کپسیدهای AAV ، بتوانند بر این چالش غلبه کنند.
لذا در این پژوهش، محققان از یک روش یادگیری عمیق محاسباتی برای طراحی انواع کپسید از سروتیپ AAV2 در توالی های DNA رمزگذار یک بخش پروتئین استفاده می کنند که در شناسایی سیستم ایمنی و همچنین هدف قرار دادن بافت های خاص نقش دارد.
محققین این پژوهش اذعان داشتند که :
"رویکرد ما به بالاترین تنوع عملکردی در بین سایر کتابخانه های کپسید تاکنون رسیده است. این بخش وسیعی از فضای توالی عملکردی اما قبلاً غیرقابل دسترسی را باز می کند ، با بسیاری از برنامه های کاربردی بالقوه برای تولید بردارهای ویروسی بهبود یافته ، مانند AAV ها با ایمنی زایی بسیار کاهش یافته و انتخاب بافت بسیار بهبود یافته و همچنین برای ژن درمانی بسیار کارآمد ، " (Dyno Therapy).
این پروژه به امید پیشرفت و کارآیی AAV در ارائه خدماتی مانند ژن درمانی است و با نگاهی اجمالی به آینده استفاده از هوش مصنوعی می تواند در طراحی داروهای جدید و همچنین رویکردهای انتقال دارو نقش ایفا کند.
سام سینا ، بنیانگذار Dyno و سرپرست تیم یادگیری ماشین ، اظهار داشت: "هرچه ما وکتور AAV را از حالت طبیعی گونه خود تغییر دهیم ، احتمال غلبه بر مشکل مصونیت قبلی نیز بیشتر است. همچنین اطمینان از زنده ماندن انواع کپسید برای بسته بندی محموله DNA با استفاده از روشهای متداول، به زمان و منابع نیاز دارد و منجر به عملکرد بسیار کمی از کپسیدهای مناسب میشود."
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470










 🧫
🧫