سلول های بنیادی راهی به آینده
-
یک مطالعه مبتنی بر مواد بیولوژیکی توسط محققان دانشگاه تورنتو با همکاری Ripple Therapeutics Inc روشی را ایجاد کرده است که کنترل بهتری بر پروفایل ترشح مواد دارویی در ایمپلنت ها دارد و می تواند بازار داروهای کلاسیک را مختل کند.
به طور معمول ، مولکول های دارویی در داخل پوسته های پلیمری قابل تجزیه یا تجزیه نشده قرار می گیرند و به آرامی داروهای درمانی را آزاد می کنند که اغلب با کنترل پروفایل های انتشار مشکل هستند. در این مطالعه ، محققان توانستند به طور مستقیم از مولکول های دارو به عنوان خود وسیله حمل و نقل استفاده کنند و روند ساخت و آماده سازی روند درمانی را برای کلینیک بسیار بهبود بخشند.
پروفسور Paul Santerre (دندانپزشک ، BME) ، نویسنده ی مسئول این مطالعه در این تحقیق می گوید: "هدف از تحقیق و کاربردهای اثبات شده آن ، ساختن یک سیستم قوی است که بتواند در تحویل کلاسهای مختلف مولکول های دارویی مورد استفاده قرار گیرد." "در این مطالعه ، ما از کورتیکواستروئیدها برای تولید ساختارهایی استفاده کردیم که خود به خود جمع می شوند و الیاف ، میله ها ، نانوذرات و اشکال دیگر را تشکیل می دهند. این فرم های قوی فرسایش سطحی را به روشی کنترل شده انجام داده و به این ترتیب دارو را برای بیش از هفته ها تا ماهها بدون کمک ماتریس ثانویه تحویل می دهند. "
کورتیکواستروئیدها اغلب به صورت بالینی برای رفع التهاب استفاده می شوند. به عنوان مثال ، آنها در محصولات تجاری رایج مانند استنشاق کننده های آسم یافت می شوند. این مولکول ها همچنین می توانند از طریق کاشت یا مهندسی بافت به مناطقی در بدن انسان منتقل شوند - جایی که یک ماده زیست تخریب پذیر به طور سنتی مولکول ها را کپسوله می کند و با گذشت زمان به آرامی آزاد می کند.
از نظر تئوری این ایده عالی است ، اما ترجمه بالینی با چالش هایی روبرو است.
https://news.engineering.utoronto.ca/new-method-can-improve-drug-delivery-in-implants/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
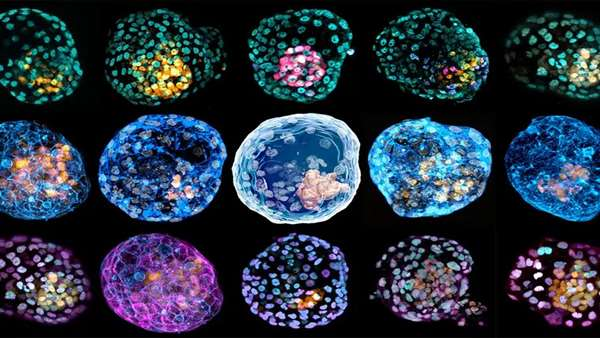
بخش عمدهای از سقطهای جنینی در دو هفته اول پس از بارداری و زمانی اتفاق می افتند که زنان از بارداری خود اطلاع ندارند. این نوع سقط با عنوان سقط خاموش شناخته میشود و علل عمده آن، عدم کاشت جنین در مراحل اولیه و یا عدم رشد آن پس از کاشت داخل رحمی است. یک تیم تحقیقاتی ، مدلی از جنین انسان با استفاده از سلولهای پوستی تولید کرده است که امکان مطالعه مراحل اولیه رشد جنین انسان، علل ناباروری، بیماریهای مادرزادی و تأثیر سموم و ویروسها روی جنینهای اولیه را برای دانشمندان فراهم میکند.
این تیم از طریق باز برنامهریزی سلولهای فیبروبلاست پوستی با استفاده از تکنیک باز برنامهریزی هستهای"Nuclear Reprogramming"موفق به ایجاد یک ساختار سلولی سه بعدی به نام iBlastoids در یک داربست ژلهای سه بعدی شده اند. این ساختار از لحاظ ظاهر و نشانگرهای مولکولی کاملا شبیه به بلاستوسیستهای انسانی بوده و ساختارهایی شبیه به توده سلولی داخلی، سلولهای اپی بلاست و اندودرم اولیه، حفره بلاستوسل و یک لایه بیرونی سلول شبیه به تروفکتودرم در آن وجود دارد. همچنین، iBlastoids میتواند باعث ایجاد سلولهای بنیادی پرتوان و تروفوبلاست شود و مدل سازی آزمایشگاهی مراحل اولیه کاشت جنین را امکان پذیر کند.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
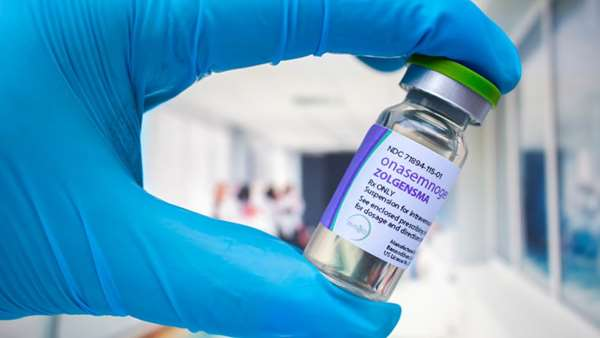
آتروفی عضلانی نخاعی یک وضعیت بسیار جدی ، ناتوان کننده و ناراحت کننده است که تأثیرات بسزایی در همه جنبه های زندگی مبتلایان به آتروفی عضلانی نخاعی و خانواده و مراقبان آنها دارد. دارویی که در حال حاضر توسط NICE برای درمان آتروفی عضلانی نخاعی نوع 1 ، 2 و 3 قبل از علائم توصیه می شود ، داروی ضد حساسیت الیگونوکلئوتید nusinersen است که باید به طور منظم مصرف شود. زولگنسما(Zolgensma) به صورت یک تزریق داخل وریدی تجویز می شود و برای استفاده در نوزادان تا 12 ماهگی با نوع 1 آتروفی عضلانی نخاعی تأیید شده است. در پیش نویس راهنمای NICE همچنین استفاده از زولگنسما در نوزادان دارای آتروفی عضلانی نخاعی پیش از علامت توصیه می شود. برای کودکان 7 تا 12 ماهه ، به دلیل محدود بودن اطلاعات بالینی موجود برای این گروه سنی ، لازم است که یک تیم بالینی چند در مورد نوع درمان آن پژوهش و بررسی کنند.
زولگنسما نشان دهنده یک پیشرفت مهم در درمان آتروفی عضلانی نخاعی است که نه تنها می تواند به کودکان اجازه دهد نقاط عطف مهم مانند نشستن و راه رفتن مستقل را بدست آورند ، بلکه برای برخی از نوزادان که قبل از علائم آنها تشخیص داده می شود ، ممکن است به عنوان یک درمان باشد. هزینه ژن درمانی برای هر دوز 1.79 میلیون پوند است. بویزن ادامه داد: همانطور که در بسیاری از روشهای درمانی جدید برای بیماریهای بسیار نادر وجود دارد ، شواهد محدود نشان می دهد که عدم اطمینان در مورد مزایای طولانی مدت زولگنسما وجود دارد. انتظار می رود که صنعت داروسازی در جهت بهبود کارایی خود برای ارائه چنین نوآوری های پرهزینه با حداقل هزینه ممکن که برای پایداری سیستم های مراقبت بهداشتی در سراسر جهان ضروری است ، کار کند.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
محققان در انستیتوی کارولینسکا استفاده از ونتوکلاکس با دوز کم را که یک داروی آزمایشی است ، برای درمان بیماری سرطان ناهمگن مولتیپل میلوما در بیماران مبتلا به عود درمان های استاندارد بررسی کرده اند. این یافته ها در مجله American Journal of Hematology منتشر شده و امید جدیدی برای درمان مولتیپل میلوما فراهم می کند.
مولتیپل میلوما (MM) یک بیماری سرطانی است که از زیرگروههای متمایزی تشکیل شده است و تقریباً 20 درصد مرگ ناشی از تمام بیماریهای مرتبط با خون را تشکیل می دهد. درمان این بیماری در دهه های گذشته ارتقا یافته است، با این حال برخی از بیماران همچنان دچار عودهای متعدد می شوند که منجر به مرگ می شود.
محققان در Karolinska Institutet، این مطالعه را بر روی 25 بیمار، دوز 400 میلی گرم در روز Venetoclax (دارویی که در حال حاضر برای درمان انواع مختلف سرطان خون استفاده می شود) را در درمان بیماران MM و AL-amyloidosis که از قبل تحت درمان قرار گرفته اند، را تجویز نمودند. این مطالعه نشان می دهد که انتخاب Venetoclax با دوز پایین برای کاهش عوارض جانبی این دارو، از نظر میزان پاسخ و زنده ماندن بسیار مهم بود.
این مطالعه در مجموع شامل 25 بیمار (17 بیمار MM و 8 AL-آمیلوئیدوز) بود که با گذشت زمان نسبت به درمان استاندارد مقاوم شده و منجر به بیماری تهاجمی تر شدند. بیماران مبتلا به ناهنجاری کروموزومی به نام t (11؛ 14) سپس با دوز کم ونتوکلاکس تحت درمان قرار گرفتند. این مطالعه نشان می دهد که درمان Venetoclax در 44 درصد از کل بیماران ، 71 درصد در AL-آمیلوئیدوز و 33 درصد در زیر گروه های MM موثر بود. در حالی که 20 بیمار (80 درصد) برخی از عوارض جانبی را مشاهده کردند ، این موارد در همه موارد قابل کنترل بود و هیچ گونه مرگ و میر ناشی از درمان Venetoclax مشاهده نشد. عارضه جانبی غالب حالت تهوع بود که در 32 درصد بیماران مشاهده شد.
نویسنده مسئول مقاله اذعان داشت: همچنین یک روش ساده را برای پیش بینی پاسخ ونتوکلاکس تا سطح 91 درصد از ویژگی های خاص ایجاد کردند. این روش درمانی می تواند برای پزشکی فرد محور مورد استفاده قرار گیرد و پیاده سازی آن در بخش پاتولوژی در بیمارستان دانشگاه کارولینسکا آسان است.
Refrence:https://medicalxpress.com/news/2021-05-treatment-multiple-myeloma.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
شانس بازیابی باروری از طریق پیوند سلول های بنیادی اسپرم به اندازه پرتاب سکه تصادفی است. اما تیمی از دانشمندان استراتژی جدیدی را ابداع کردند که به عنوان "سکه ای وزن دار" عمل می کند و می تواند برای دستیابی به نتایجی که در آن باروری با موفقیت بازیابی می شود، شانس بیشتری ایجاد کند.
توانایی سلول های بنیادی در رفع عملکردهای ضعیف بافت های میزبان پس از پیوند، یک موفقیت نجات دهنده در درمان شرایط غیرقابل درمان قبلی بوده است. سرنوشت سلول های بنیادی پیوندی تقریباً مانند پرتاب سکه غیرقابل پیش بینی است. پس از پیوند، ممکن است آنها تکثیر شده، به یک نوع بافت دیگر تبدیل شوند یا از بین بروند.
سلولهای بنیادی اسپرماتوگونیال نیز از همان سرنوشت تصادفی پیش بینی نشده در نتایج پیروی می کنند. اما گروهی از دانشمندان باروری به سرپرستی یوشیاکی ناکامورا از دانشگاه هیروشیما روش جدیدی را کشف کردند که به خوبی ناباروری موش های نر را درمان میکند - این نوید خوبی برای برنامه های آینده در بازسازی اسپرم انسان پس از درمان سرطان و جمعیت دوباره گونه های تهدید شده و در معرض خطر است. نتایج مطالعه آنها در مجله Cell Stem Cell منتشر شده است.
تیم بین المللی دانشمندان ژاپنی و انگلیسی با نگاهی به وضوح و از نزدیک به تک سلولی ها، سرنوشت سلولهای بنیادی اسپرماتوگونیال پیوند یافته در موش ها را پیگیری کردند. آنها سلولهای بنیادی اسپرم موش را در موش های نابارور کاشتند و دریافتند که در دراز مدت فقط یک بخش کوچک از آنها به عنوان اسپرماتوگونی کار می کند و بقیه به انواع دیگری از سلول ها تغییر می کنند، یا عملکردشان متوقف شده و مرگ سلولی رخ می دهد.
آنها با استفاده از این دیدگاه ها، روش جدیدی را ایجاد کردند که می تواند به طور مصنوعی سرنوشت سلول های بنیادی اسپرم را تنظیم کند تا احتمال افزایش مجدد جمعیت را به حدی برساند که مجددا باروری برقرار شود. به طور خلاصه، آنها پس از پیوند، از یک بازدارنده سنتز اسید رتینوئیک استفاده می کنند که به طور موقت از تمایز سلول های بنیادی اسپرم جلوگیری می کند. بازدارنده های شیمیایی در جایی که سلول های بنیادی سرنوشت تجدید حیات خود را انتخاب می کنند، به ایجاد نتیجه کمک می کند.
https://www.sciencedaily.com/releases/2021/06/210607161035.htm
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
بنا به اظهار محققان، سلول های بنیادی، سلول های مغزی جدیدی تولید می کنند که برای یادگیری و حافظه در طول زندگی فرد بالغ ضروری هستند. اگر این سلول های بنیادی بدون کنترل تقسیم شوند، ذخایر آن ها تمام می شود. به نظر می رسد ژن FOXO3 با جلوگیری از تقسیم سلول های بنیادی تا زمانی که استرس وجود دارد، نقش خود را ایفا می کند.
از جمله عواملی که باعث استرس بافت مغز می شود می توان به التهاب، تشعشعات و یا فقدان مواد غذایی کافی اشاره کرد. در این پژوهش به طور اختصاصی به بررسی اثر مواجهه سلول های بنیادی مغز با استرس اکسیداتیو (که ناشی از تولید گونه های مضر اکسیژن در بدن می باشد) پرداخته شده است. نتایج نشان می دهد که پروتئین FOXO3 مستقیما تحت تاثیر استرس اکسیداتیو قرار می گیرد، به طوریکه FOXO3 به هسته سلول های بنیادی منتقل می شود و در آنجا ژن های پاسخ به استرس را فعال می کند. این پاسخ، منجر به تخلیه یک ماده مغذی به نام S-آدنوزیل متیونین (SAM) می شود که برای همکاری با پروتئین لامین در تشکیل یک پوشش در اطراف DNA در هسته سلول های بنیادی ضروری است. در فقدان SAM، لامین نمی تواند این مانع قوی را تشکیل دهد و سلول این DNA بدون پوشش را با یک عفونت ویروسی اشتباه گرفته و منجر به نوعی پاسخ ایمنی به نام پاسخ اینترفرون نوع یک می شود. این امر باعث می شود سلول بنیادی خاموش شده و تولید سلول های عصبی جدید متوقف شود.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
پژوهشگران چینی در آکادمی علوم پکن یک غربالگری مبتنی بر CRISPR/Cas9 گسترده را با استفاده از دو نوع سلول پیش ساز مزانشیمی انسانی که پیری تسریع شده را نشان می دهند، انجام دادند. این سلول های پیش ساز مزانشیمی از سلول های بنیادی جنینی انسانی مشتق شدند که حامل جهش های بیماری زایی بودند که منجر به بیماری پیری تسریع شده سندرم ورنر و سندرک پروجریای هاچینسون-گلیفورد می شوند.
با استفاده از این مدل ها، محققین ژن هایی را شناسایی کردند که نقصان آن ها منجر به پیری سلولی می شود و در هر دو مدل پیری سلولی ذکر شده وجود داشتند که از جمله آن ها می توان به KAT7 اشاره کرد که یک هیستون استیل ترانسفراز است. غیر فعال سازی KAT7 موجب کاهش استیلاسیون هیستون H3 شد و این امر نیز موجب سرکوب رونویسی شد و پیری سلول های پیش ساز مزانشیمی را کاهش داد. به عقیده محققین استفاده از غربالگری ژنتیکی مبتنی بر CRISPR/Cas9، یک روش قوی برای کشف ژن های دخیل در پیری مانند KAT7 است و می توان آن ها را هدف درمانی مناسبی برای ایجاد مداخلات درمانی برای پیری دانست.
https://stm.sciencemag.org/content/13/575/eabd2655
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

سرفصل ها
روز نخست
معرفی سلول درمانی و ژن درمانی (چیستی و ماهیت، تفاوت ها)
چرا سلول درمانی؟ چرا ژن درمانی؟ (ضرورت انجام سلول درمانی و ژن درمانی)
روشهای انجام سلول درمانی و ژن درمانی (معرفی روش ها و ابزارهای مورد نیاز در سلول درمانی)
کارگاه آموزشی کشت و نگهداری سلول های بنیادی جنینی
روز دومباید ها و نبایدهای سلولدرمانی و ژن درمانی (بیان محدودیت ها و چالش های سلول درمانی)
معرفی بازار و ظرفیت های تجاری
کارگاه آموزشی نحوه کشت و نگهداری سلول های بنیادی مزانشیمی مغز استخوان
روز سوممهندسی بافت (ساخت اندام های بدن در آزمایشگاه)
کارگاه آموزشی روش های انتقال ژن
برگزاری آزمونhttps://www.royan-edu.ir/product/2th-royan-summer-school/
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

https://www.royan-edu.ir/product/هفدهمین-کنگره-بین-المللی-سلولهای-بنیا/
https://www.royan-edu.ir/product/بیست-و-دومین-کنگره-بین-المللی-بیولوژی-ت/
z Gheibi
romisa
فارغ-التحصیلان-آلاء
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
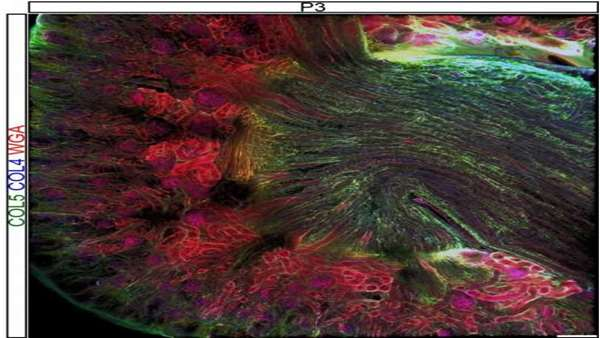
یک آزمایشگاه جدید در CU Boulder در حال بررسی چگونگی تأثیر ماتریکس خارج سلول بر رشد، تکوین و عملکرد کلیه ها می باشد. کار این تیم که اخیراً در مجله انجمن نفرولوژی آمریکایی شرح داده شده است، باعث روشن شدن ناشناخته هایی در زمینه ی ماتریس، مهندسی بافت و کلیه می شود.
دکتر سارا لیپ، اولین نویسنده مقاله، گفت: " کلیه مواد زائد و نمک را از بدن دفع کرده و تعادل آب را بازیابی کرده و همچنین در تولید هورمون نقش دارد. "
وی گفت: "ماتریس خارج سلول برای تشکیل کلیه و عملکرد طبیعی کلیه بسیار مهم است. با این وجود چگونگی تغییر ترکیب ماتریس و ساختار آن با تکوین کلیه قبلاً ناشناخته بود. در این مقاله، ما به هر دو جنبه ی شکل گیری اولیه و بالغ شدن کلیه با استفاده از یک موش که مدلی برای بررسی کلیه ی انسان است، توجه کردیم."
این تحقیق بخشی از تلاشهای مداوم در مهندسی بافت است که در آن سلولها، ماتریس و فاکتورهای رشد را برای الگو برداری از عملکرد اندام ترکیب می کنند. انجام این کار به طور بالقوه باعث تغییر شکل پزشکی بازساختی شده و با ایجاد گزینه ی اندام مصنوعی به جای اندام های اهدایی، بانک کلیه های موجود را افزایش می دهد.
کالو گفت آزمایشگاه وی این تحقیق را در CU Boulder ادامه خواهد داد. ساختار و ترکیب توصیف شده در مقاله می تواند به عنوان یک راهنمای اولیه برای مهندسان بافت که کلیه را مطالعه می کنند، استفاده شود.
وی گفت: "آزمایشگاه ما در درجه اول بر درک ترکیبات ماتریکس خارج سلولی، ساختار و مکانیک سیستم تکوین عضله ی اسکلتی متمرکز است، بنابراین انشعاب در کلیه یک چالش خوشایند است." "هنوز چیزهای زیادی برای کشف و کار در این زمینه وجود دارد چرا که ما روندهای جالبی را در ماتریکس خارج سلولی بینابینی به عنوان یک شبکه فیبری بین سلول ها مشاهده کرده ایم و اکنون در حال بررسی آنچه در یک مدل رشد غیر طبیعی کلیه در مرحله جنینی اتفاق می افتد هستیم."
https://medicalxpress.com/news/2021-06-paves-kidney-treatment-potential-synthetic.html
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
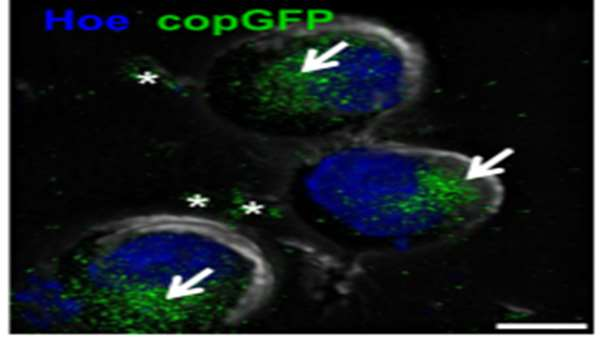
خون بند ناف (CB) منبعی از سلولهای بنیادی و پیش ساز خونساز (CB-HSPCs) برای بازسازی مغز استخوان (BM) را نشان می دهد، اما کمبود تعداد CB-HSCPC و روشهای ex vivo برای افزایش عملکرد CB-HSPC، باعث محدود شدن کاربرد بالینی CB در بیماران بالغ شده است.
از آنجا که سلولهای بنیادی پرتوان ناشی از انسان (hiPSC) به عنوان سلولهای اهدا کننده وزیکولهای فعال خارج سلولی (EVS) که خصوصیات دیگر سلولها را تغییر می دهند، شناخته شده اند، تیم تحقیقاتی از دانشگاه Jagiellonian لهستان که گزارش خود را در 17 ژوئن در Natture چاپ کرده اند، اولین کسانی هستند که EVS مشتق از( (hiPSC-Evs را برای افزایش پتانسیل تولید سلولهای خون ساز از CB-HSPCs استفاده می کنند.
آنها نشان دادند که hiPSC-EV ها باعث بهبود خواص عملکردی CB-HSPC ها در جهت ظرفیت خونسازی شان از جمله پتانسیل متابولیک، خونسازی و کلونوژنیک و همچنین بقا، پاسخ شیمی درمانی به فاکتور 1 مشتق شده از سلول استرومایی و چسبندگی به اجزای مدل نیچ هماتوپویتیک در شرایط آزمایشگاهی می شوند.
علاوه بر این، hiPSC-EV ها لانه گزینی و پیوند CB-HSPC ها را در داخل بدن افزایش می دهند. این پدیده ممکن است مربوط به فعال شدن مسیرهای سیگنالینگ در CB-HSPCs پس از درمان با hiPSC-EV باشد، همانطور که در بیان ژن و سطح فعالیت پروتئین کینازها نشان داده شده است.
در نتیجه، hiPSC-EV ها ممکن است به عنوان تعدیل کننده های موجود در ظرفیت CB-HSPC برای افزایش خواص عملکردی آنها و تقویت برنامه های عملی آینده سلول های مشتق شده از CB در بازسازی BM استفاده شود.
https://www.nature.com/articles/s41375-021-01325-y
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
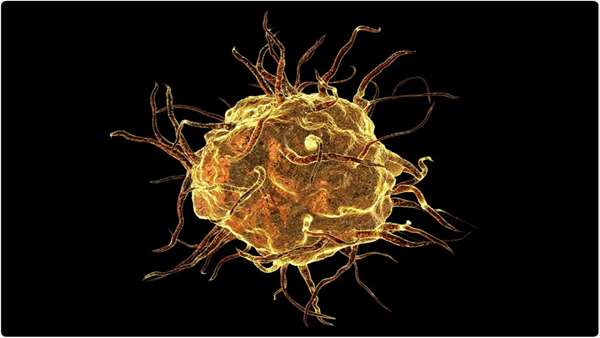
توانایی سمندرها در تولید اندامهای از دست رفته راز علمی بزرگی است که هزاران سال محققان دنیای طبیعی را مجذوب خود کرده است؛ قابلیتی که در پستانداران بالغ از جمله انسان دیده نمیشود. در پستانداران به جای بازسازی اعضای از دست رفته یا آسیب دیدهی بدن، اسکاری در محل آسیب ایجاد میشود که مانع فیزیکی اصلی در القای بازسازی است.
در حالی که در سمندرها این اسکار ایجاد نشده و این همان چیزی است که اجازه می دهد بازسازی انجام شود. تیم تحقیقاتی آزمایشگاه زیستی به سرپرستی دکتر James Godwin موفق به شناخت نقش حیاتی ماکروفاژها در القای بازسازی در سمندر شدند. نتایج آزمایشهای آنها نشان داد که اگرچه مسیرهای پاسخدهی ماکروفاژها در سمندر و موش هنگامی که در معرض عوامل بیماریزا مانند باکتریها، قارچ ها و ویروس ها قرار میگیرند مشابه است، اما در هنگام مواجهه با آسیب این داستان متفاوت است و ماکروفاژها در سمندر باعث رشد بافت جدید شده در حالی که در موش باعث ایجاد اسکار می شوند. این تیم تحقیقاتی امیدوار است با شناخت مسیرهای سیگنالینگ دخیل در پاسخدهی ماکروفاژهای سمندر به آسیب بافتی، راه جدیدی در توسعه رویکردهای پزشکی بازساختی در انسان پیدا کند.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

محققان موسسه Wake Forest for Regenerative Medicine یک تکنیک مهندسی بافت را برای ایجاد عضلات اسکلتی ایجاد کرده اند که سلولهای عصبی را بهینه تر در بافتهای پرینت شده، وارد می کند.
رویکردهای سنتی برای درمان نقایص گسترده عضلانی اغلب ,مفید فایده نبوده که این امر می تواند منجر به عدم توانایی عصب در جایگیری صحیح در بافت عضلانی شوند. این روش ها عمدتا با استفاده از جراحی ترمیمی و پیوند عضلات صورت میگیرد که گاها می توانند منجر به عدم تحرک و کنترل شوند.
این رویکرد چاپ ترکیبی می تواند گامی حیاتی در راستای امکان استفاده از بافت های عضلانی اسکلتی مهندسی زیستی برای معالجه بیماران باشد. این فناوری می تواند به ویژه در معالجه سربازانی که به دنبال آسیب دیدگی شدید از مواد منفجره دست ساز در حین انجام کار فعال هستند ، مفید واقع شود.
پیش از این ، تیم نشان داده بود که سیستم چاپ و اندام چاپی یکپارچه (ITOP) آنها قادر به تولید بافت عضلانی سه بعدی است، که به اندازه کافی سازمان یافته و قوی بوده و ساختار اصلی آن را حفظ می کند.
در مطالعات اخیر،این تیم به دنبال تولید بافت عضلانی عملکردی ، ترکیبات مختلفی از سلول ها و انواع مختلف ساختارهای عضلانی اسکلتی را آزمایش کرده است.
نتایج تحقیقات این تیم در نشریه Nature Communications منتشر شده است و هم اکنون ادغام سلول های عصبی در بافت عضله اسکلتی که توسط چاپگر زیستی ایجاد شده را به منظور تسریع بازسازی عملکردی عضلات بررسی کرده است.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -

تجهیزات پیشرفتهای که با چشم غیر مسلح قابل مشاهده نیستند و ابعادی میکرونی دارند، به کمک فناوریهای هوش مصنوعی و الکترونیک کار پژوهش، تشخیص و درمان بیماری را آسان کردهاند.
سیالات و تجهیزات دارای ابعاد میکرونی یکی از فناوریهای نوظهور در فناوری زیستی و سلولی است که با قابلیتهای منحصربهفردی که تجهیزات هوشمند ریزمایعات یا میکروفلوئید یکی از ابزارهایی هستند که در اندازههای کمتر از یک میکرون امکان مطالعه و جداسازی بافتهای سلولی و زیستی را فراهم میکنند.
درمان هوشمند و فناورانه بیماریها
سرطان یکی از عارضههای صعبالعلاج و شایع این روزهای جهان صنعتی است که همچنان روشهای تهاجمی و درگییرکننده بافتهای بدن از جمله شیمی درمانی یا پرتودرمانی، راهکاری قطعی برای درمان آن نبوده و عارضههای جانبی بسیاری را برای بیمار ایجاد میکند.
به کمک تجهیزات فناورانه ریزسیال اما راهی برای بهبود و درمان پیدا شده است. این تجهیزات ضمن آنکه میتوانند دارورسانی را به صورت هوشمند به بافتهای بیمار از جمله غدد سرطانی برسانند، امکان مشخص کردن وشناسایی و جدا کردن سلولهای سرطانی از سلولهای سالم خون و بافت را محقق میکنند.
تجهیزات یادشده دارای دریچههایی با ابعاد میکرومتری هستند که امکان عبور مایعاتی مانند دارو یا ذرات کمتر از یک میلیمتر را ایجاد میکنند. میکروفلوئید به شکلی پرکاربرد در سلولهای بنیادی و فرآوردههای زیستی، کاربرد دارند.
تجهیزات میکروسیال، ضمن کاهش هزینههای درمان میتوانند به طور خودکار و هوشمند روند درمان را رصد کرده و آمارهای دقیق را به گروه درمانگر یا پژوهشگران فناوریهای زیستی یا سلولهای بنیادی، اعلام کنند.
استفاده از تجهیزات میکروسیال، میتواند ضمن خودکارسازی فرآیند درمان، محدودیتهای پژوهش بر روی بافتها و اندامهای داخلی را از میان برداشته و ضمن توسعه آزمایشهای دقیق و کاربردی، افزایش کارایی داروها یا تجهیزات پزشکی را به ارمغان بیاورد.
اما این تجهیزات چگونه کار میکنند؟ این ابزارها مبتنی بر نفوذ سیالات دارای ابعاد بسیار ریزابعاد است و بر همین اساس، فناوری میکروفلوئیدیک با استفاده از یک بخش سختافزاری برای انتقال مایع و یک تراشه هوشمند، مایعات را با دقتی بالا با سرعت بسیار پایین و دقتی بالا منتقل میکنند. از طریق این ابزار میتوان نانوداروها یا مواد آهسته رهش را که اثرگذاری بسیار بالایی در درمان اختصاصی بخش بیمار ایفا میکنند، انتقال داد.
ویژگیهای منحصر به فرد تجهیزات میکروسیال
با توجه به دقت بسیار بالا و ابزارهای هوشمند برای میزان مایع مورد استفاده و تعیین دقیق سرعت و فشار انتقال مایع، کیفیت کار درمان و تحقیق با ابزارهای مبتنی بر این فناوری بسیار بالا است و نتایج مطلوبی را نیز به ویژه در پژوهشها به جا گذاشته است. همچنین زیستسازگاری بالا و عدم ایجاد حساسیت در بدن از مزیتهایی است که به توسعه فناوری میکروسیالها و استقبال بخشهای پژوهشی و فناورانه منجر شده است.
با توجه بیشتر شرکتهای فعال در حوزه تجهیزات پزشکی و رونق تولید ابزارهای مبتنی بر فناوری ریزسیالها، قیمت تمام شده درمان کاهش خواهد یافت و با امکان درمان اختصاصی و قطعی بسیاری از بیماریهای صعبالعلاج به این روش نوآورانه، هزینههای اختصاص یافته به تجهیزات، داروها و نگهداری از بیماران خاص به توسعه فناوری سلولهای بنیادی و فناوریهای زیستی اختصاص خواهد یافت.
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470 -
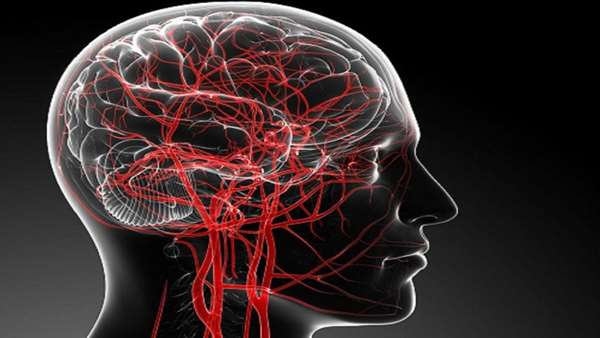
محققان در مطالعه اخیرشان از یک روش جدید و غیرتهاجمی برای اندازهگیری جریان خون مغزی با نور خبر دادهاند. به گفته محققان میتوان از این روش برای تشخیص فعالیت مغز استفاده کرد. این روش جدید که طیف سنجی موج پخش کننده تداخل سنجی عملکردی(fiDWS) نام دارد، ارزانتر از فناوری موجود است و میتوان از آن برای ارزیابی آسیبهای مغزی یا انجام تحقیقات علوم اعصاب استفاده کرد. ویوک سینیواسان"(Vivek Srinivasan) محقق این مطالعه گفت: با استفاده از این روش ما میتوانیم میزان عملکرد مغز در تنظیم جریان خون و فعالیت مغز را به صورت غیرتهاجمی در انسان ارزیابی کنیم. دو درصد از وزن بدن انسان را مغز تشکیل میدهد اما ۱۵ تا ۲۰ درصد جریان خون را از قلب میگیرد.
اندازهگیری جریان خون مغزی برای تشخیص سکتههای مغزی و پیشبینی آسیب ثانویه در خونریزیهای زیر عنکبوتیه یا آسیبهای مغزی مهم است. پزشکانی که در بخش مراقبتهای ویژه عصبی هستند با تصویربرداری از جریان خون مغز و بررسی میزان اکسیژن رسانی سطح بهبودی بیمار را کنترل میکنند. فناوریهای موجود برای تشخیص این امر گران است و نمیتوان از آنها به طور مداوم استفاده کرد. به عنوان مثال در حال حاضر برای تصویربرداری از جریان خون مغزی به ام آر ای یا اسکنر توموگرافی کامپیوتری نیاز است که هزینه هر دوش روش بالا است. فناوریهای دیگری مانند فناوریهای مبتنی بر نور مانند طیفشناسی فروسرخ نزدیک نیز وجود دارند اما این روشها نیز دارای اشکالاتی همانند دقت در اندازه گیری هستند.
اما نحوه عملکرد روش جدید اینگونه است که طی آن نور فروسرخنزدیک از طریق بافتهای بدن به داخل مغز نفوذ میکند. اگر لیزر فروسرخنزدیک را به پیشانی فردی بتابانید، نور بارها توسط بافت(از جمله سلولهای خونی) پراکنده میشود. با برداشتن نوسان سیگنال نوری که از جمجمه و پوست سر عبور میکند پزشکان میتوانند اطلاعاتی در مورد جریان خون در داخل مغز بدست آورند.
https://advances.sciencemag.org/content/7/20/eabe0150
اینجا

 میتونی بی واسطه با سلول های بنیادی حرف بزنی!
میتونی بی واسطه با سلول های بنیادی حرف بزنی!

https://forum.alaatv.com/post/1396470










 🧫
🧫