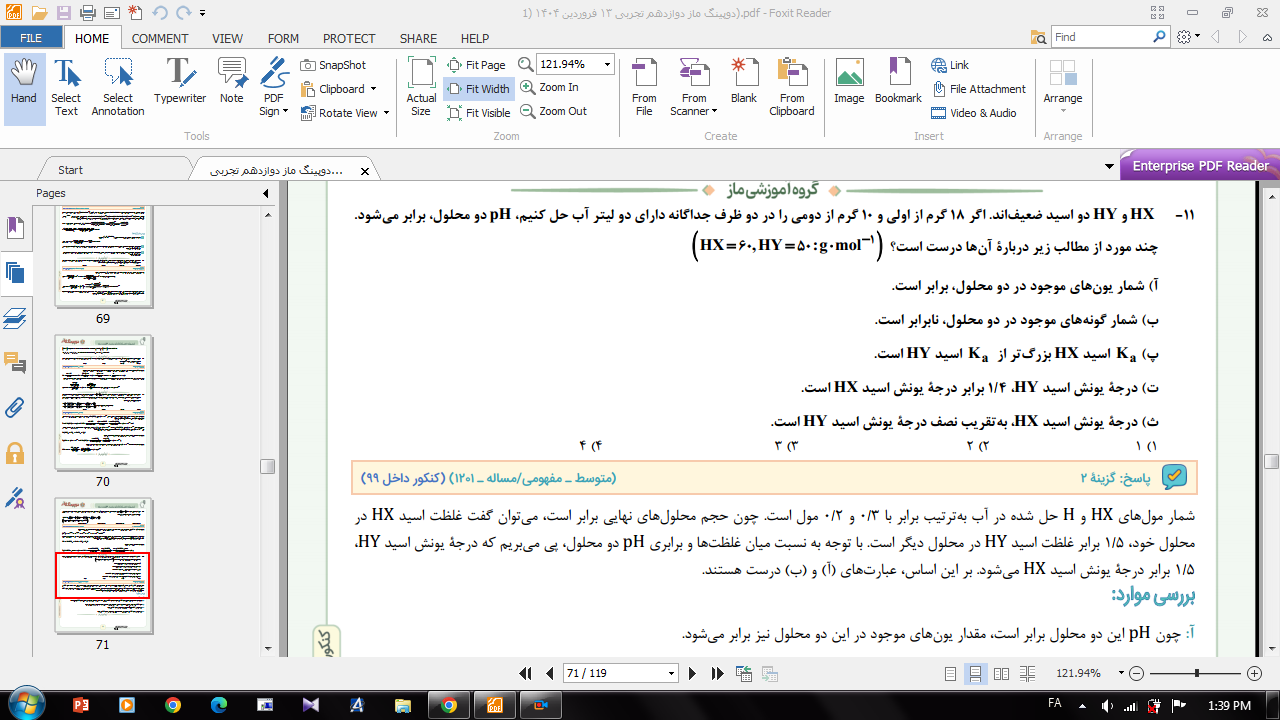
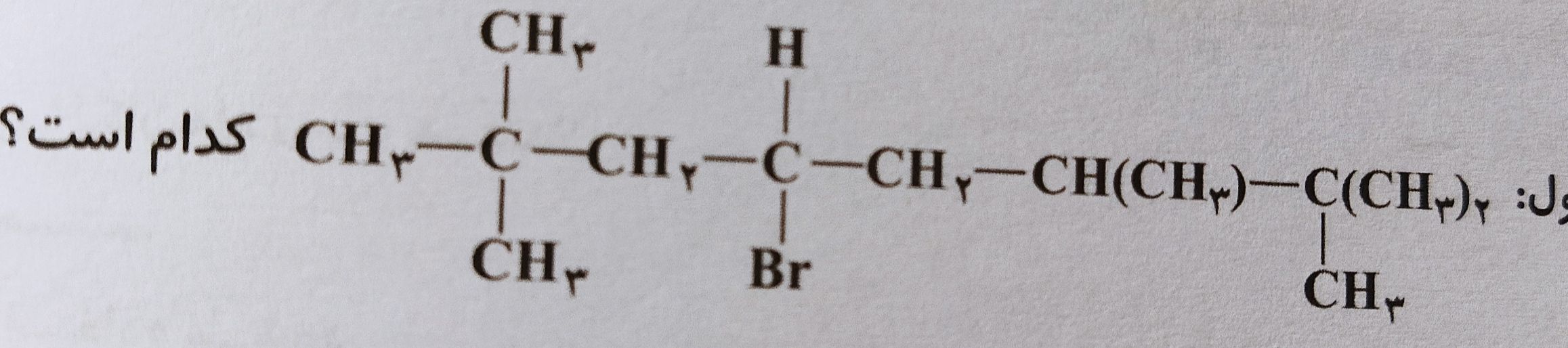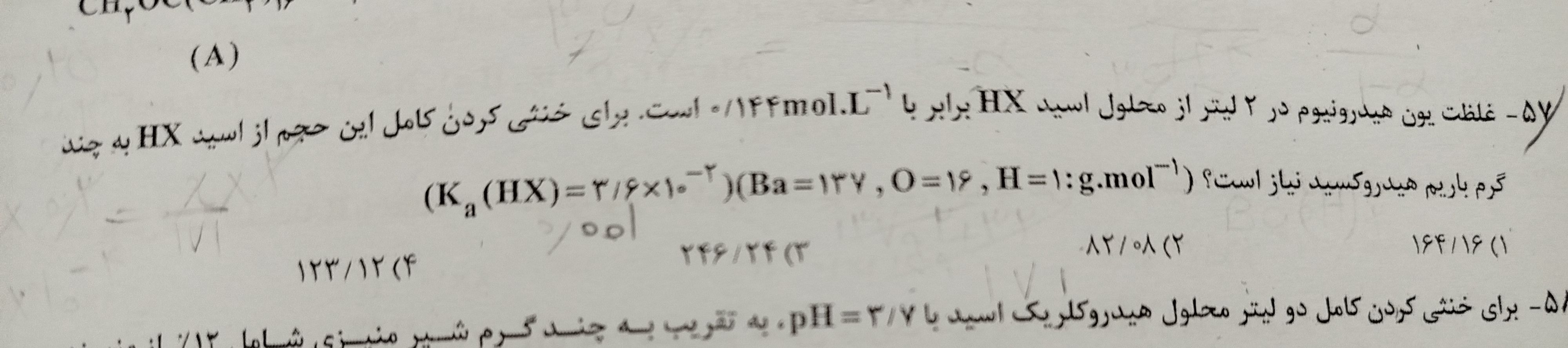سوال از خنثی شدن اسید باز
-
دوستان عزیز یه مشکلی پیش اومده، دقیق نمیتونم مفهوم این مشکل رو درک کنم.
در تصاویر، دو سوال رو نوشتم براتون. هر دو سوال مربوط به خنثی شدن اسید باز.
سوال اول رو از یه روشی حل کردو، که ساده ست و جواب میده و قابل درک هست. ولی سوال دوم، از راه اصلی باید حل بشه و وقتی میخوام از روشی که اولی رو حل کردم حل کنم، یکجا به مشکل میخورم و میدونم که غلطه، ولی دلیلش رو کامل تفهیم نمیشم. کسی میتونه توضیحی ارائه بده؟!


-
سوال اولو هم غلط حل کردین ، باریم هیدروکسید اسید دو ظرفیتیه شما اصن ظرفیتشونو در نظر نگرفتین در ضمن باید واکنش خنثی سدن بنویسین اگه موازنه کنین میبینین نسبت هیدروکلریک اسید و باریم هیدروکسید یک به یک نیست
-
سوال اولو هم غلط حل کردین ، باریم هیدروکسید اسید دو ظرفیتیه شما اصن ظرفیتشونو در نظر نگرفتین در ضمن باید واکنش خنثی سدن بنویسین اگه موازنه کنین میبینین نسبت هیدروکلریک اسید و باریم هیدروکسید یک به یک نیست
@mahdis127
اتفاقا جالبی راهیکه سوال اول رو حل کردم همینه، ربطی به ظرفیت نداره. جواب درسته سوال اول شکی نیست. -
سوال اولو هم غلط حل کردین ، باریم هیدروکسید اسید دو ظرفیتیه شما اصن ظرفیتشونو در نظر نگرفتین در ضمن باید واکنش خنثی سدن بنویسین اگه موازنه کنین میبینین نسبت هیدروکلریک اسید و باریم هیدروکسید یک به یک نیست
@mahdis127
سوال من اینه، میدونم این روش برای سوال دچم درست نیست، ولی نمیتونم تفهیم کنم چرا غلطع -
دوست عزیز سوال اولو استباه حل کردین مگه میشه به مقدار مول برابر از دو ماده برداریم و خنثی شن ،به ازای هرمول باریم هیدروکسید دو مول هیدروکلریک مصرف میشه ،شما اینو از کدوم کتاب دیدی؟
-
سوال دوم راه اولتون درسته ،سوال اول و راه دوم سوال دومتون غلطه ،
-
دوست عزیز سوال اولو استباه حل کردین مگه میشه به مقدار مول برابر از دو ماده برداریم و خنثی شن ،به ازای هرمول باریم هیدروکسید دو مول هیدروکلریک مصرف میشه ،شما اینو از کدوم کتاب دیدی؟
این پست پاک شده! -
دوست عزیز سوال اولو استباه حل کردین مگه میشه به مقدار مول برابر از دو ماده برداریم و خنثی شن ،به ازای هرمول باریم هیدروکسید دو مول هیدروکلریک مصرف میشه ،شما اینو از کدوم کتاب دیدی؟
این پست پاک شده! -
دوست عزیز سوال اولو استباه حل کردین مگه میشه به مقدار مول برابر از دو ماده برداریم و خنثی شن ،به ازای هرمول باریم هیدروکسید دو مول هیدروکلریک مصرف میشه ،شما اینو از کدوم کتاب دیدی؟
@mahdis127
من وااااقعا بابت پاسخ و وقت شما ممنونم، خیلی متشکرم،
ولی خواهش میکنم عحله نکنید، اول سوال من رو دقیق متوجه بشید، بعد اگر "خودتون کامل بلد بودید" جواب بدید،
که در هر صورت من از توجه شما خیلی ممنونم


-
VictorKeke
این روشی که شما گفتین برای این توو سوال اول جواب میده که هم اسید قوی داریم و هم باز قوی و درجه یونش هردوشون یک هستش.
اما همونطور که می بینید توو سوال دوم جواب نمیده چرا ؟
چون هم اسید و هم بازمون ضعیف هستن و درجه یونش اسید رو گفته. -
VictorKeke
این روشی که شما گفتین برای این توو سوال اول جواب میده که هم اسید قوی داریم و هم باز قوی و درجه یونش هردوشون یک هستش.
اما همونطور که می بینید توو سوال دوم جواب نمیده چرا ؟
چون هم اسید و هم بازمون ضعیف هستن و درجه یونش اسید رو گفته.@romisa1234
خب ایول تا اینجاش رو میدونم،خیلی عالی اشاره کردین،
ولی راه حلی که برای سوال دوم جواب داده، چطور بدون در نظر گرفتن درجه تفکیک آمونیاک، جواب میده؟ ما از روی درصد تفکیک، غلظت اسید رو حساب میکنیم، درست. ولی بعد غلظت در حجم ضرب میکنیم و حجم باز میاد این قسمتش کامل مفهوم نیست.
این قسمتش کامل مفهوم نیست. -
@mahdis127
من وااااقعا بابت پاسخ و وقت شما ممنونم، خیلی متشکرم،
ولی خواهش میکنم عحله نکنید، اول سوال من رو دقیق متوجه بشید، بعد اگر "خودتون کامل بلد بودید" جواب بدید،
که در هر صورت من از توجه شما خیلی ممنونم


VictorKeke دوست عزیز. من میفهمم چی دارم میگم ،اصلا اسید و بازم بذاریم کنار از لحاظ استوکیومتری حل شما منطقی نیست ،من بهتون اشاره کردم واکنش خنثی شدن بنویسید ،یا اگه خیلی مطمئنین اون کتابی که توش این سوال بودو بیارین ماهم متوجه بشیم
-
VictorKeke دوست عزیز. من میفهمم چی دارم میگم ،اصلا اسید و بازم بذاریم کنار از لحاظ استوکیومتری حل شما منطقی نیست ،من بهتون اشاره کردم واکنش خنثی شدن بنویسید ،یا اگه خیلی مطمئنین اون کتابی که توش این سوال بودو بیارین ماهم متوجه بشیم
@mahdis127
خب الان فرق کرد قضیه، اگه شما توضبح بخواید من توضیح میدم قسمت اول رو.
جریان اینه که وقتی در یک اسید و باز قوی شما فقط غلظت یون هیدرونیم و هیدروکسید رو دارید، به سادگی با مساوی قرار دادن این یونها میتونید خنثی شدن رو بررسی کنید. چون پ هاش از جنس غلظت هست و یک مقیاس شدتی هست، در این حالت ربطی نداره که فلان مول یون هیدروکسید را کدام ماده داده، چیزی که مهمه اینه که این مقدار غلظت یون هیدروکسید داریم، پس با ضرب کردن در حجم محلول به تعداد یونهای هیدروکسید میرسیم.
در آخر، سوال خود من رو زمین موند
-
اها من فهمیدم کجا اشتباه کردم بببنید سوال اولو شما شانیسی درست بدست اوردید چون ظرفیت باز 2 بود و ضریب استوکیومتری هیدروکلریک اسیدم 2 بود ،
-
اها من فهمیدم کجا اشتباه کردم بببنید سوال اولو شما شانیسی درست بدست اوردید چون ظرفیت باز 2 بود و ضریب استوکیومتری هیدروکلریک اسیدم 2 بود ،
@mahdis127
چرا گیر دادین به روش اول؟

توضیح دادم که! روش اول انحصارن به غلظت یونها ربط داره، نه ضریب چیزی
-
اها من فهمیدم کجا اشتباه کردم بببنید سوال اولو شما شانیسی درست بدست اوردید چون ظرفیت باز 2 بود و ضریب استوکیومتری هیدروکلریک اسیدم 2 بود ،
@mahdis127
من خیلی خیلی از وقت شما متشکرم، ولی میشه صرفا بیخیال بشید و بگید بلد نیستید سوالم رو؟ بخدا تاج سرید شما، من ارادتمند شما هستم، ولی نه تنها سوال اصلی من رو جواب ندادید بلکه دو روزه سر یک مسئله ساده دارید بحث میکنید. -
tamom
@njzamin
@romisa1234
@Soheil95s95
@zahra-m1999 -
@romisa1234
خب ایول تا اینجاش رو میدونم،خیلی عالی اشاره کردین،
ولی راه حلی که برای سوال دوم جواب داده، چطور بدون در نظر گرفتن درجه تفکیک آمونیاک، جواب میده؟ ما از روی درصد تفکیک، غلظت اسید رو حساب میکنیم، درست. ولی بعد غلظت در حجم ضرب میکنیم و حجم باز میاد این قسمتش کامل مفهوم نیست.
این قسمتش کامل مفهوم نیست.VictorKeke در سوال از خنثی شدن اسید باز گفته است:
@romisa1234
خب ایول تا اینجاش رو میدونم،خیلی عالی اشاره کردین،
ولی راه حلی که برای سوال دوم جواب داده، چطور بدون در نظر گرفتن درجه تفکیک آمونیاک، جواب میده؟ ما از روی درصد تفکیک، غلظت اسید رو حساب میکنیم، درست. ولی بعد غلظت در حجم ضرب میکنیم و حجم باز میاد این قسمتش کامل مفهوم نیست.
این قسمتش کامل مفهوم نیست.ما مول اون دو تا رو مقایسه می کنیم غلظت در حجم.
اگه مول یکی رو داشته باشیم و غلظت اون یکی دیگه رو ، حجم اون یکی دیگه بدست میاد -
@mahdis127
شما اگه از روش تشریحی هم حل کنید ، همین جواب بدست میاد
چون ظرفیت توو این روش در واقع ساده میشه
شانسی نبوده.
اگه اونجا برای بدست آوردن مولار اسید ، باید غلظت یون هیدرونیوم رو تقسیم بر ظرفیت می کردیم دوباره پایینش باید ضربدر ظرفیت می کردیم تا اون یکی دیگه رو بدست بیاریم. -
@romisa1234
خب ایول تا اینجاش رو میدونم،خیلی عالی اشاره کردین،
ولی راه حلی که برای سوال دوم جواب داده، چطور بدون در نظر گرفتن درجه تفکیک آمونیاک، جواب میده؟ ما از روی درصد تفکیک، غلظت اسید رو حساب میکنیم، درست. ولی بعد غلظت در حجم ضرب میکنیم و حجم باز میاد این قسمتش کامل مفهوم نیست.
این قسمتش کامل مفهوم نیست.VictorKeke در سوال از خنثی شدن اسید باز گفته است:
@romisa1234
خب ایول تا اینجاش رو میدونم،خیلی عالی اشاره کردین،
ولی راه حلی که برای سوال دوم جواب داده، چطور بدون در نظر گرفتن درجه تفکیک آمونیاک، جواب میده؟چون ما از روی مولار آمونیاک ، مولش رو به دست میاریم و نیازی به داشتن درجه تفکیکش نیست.
غلظت در حجم در ظرفیت که میشه مولش.مولار اسید رو از راه غلظت یون هیدرونیوم به دست میاریم بعد در حجم و ظرفیت اسید ضرب می کنیم مولش به دست میاد بعد با مول آمونیاک مقایسه می کنیم